(1)阿波罗宇宙飞船使用的是以KOH为介质的氢、氧燃料电池(如下图),按下列要求填空: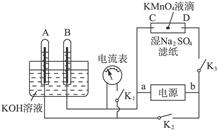
(1)①__________(填“负”或“阴”)极反应式:;②__________(填“正”或“阳”)极反应式:_________________;③电池反应式_________________________________。
(2)如图所示装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3通直流电,回答下列问题:
①判断电源的正、负极:a为___________极,b为极___________。
②在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象?______________________。
③写出电极反应式:A极______________________,C极______________________。
④若A极产生气体的体积在标准状况下为x L,则C极上产物的质量大约为___________g。
⑤若电解一段时间后,A、B中均有气体包围电极,此时切断K2、K3,闭合K1,则电流表的指针是否移动___________(填“是”或“否”)。若电流表指针不移动说明理由,若指针移动也说明理由。
已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要
原料合成一种具有果香味的物质E,其合成路线如下图所示。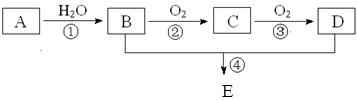
已知:醛可氧化生成羧酸。回答下列问题:
(1)写出下列物质的结构简式:ADE
(2)写出下列反应的化学方程式,并注明反应类型:
①、
②、
新合成的一种烃,其碳架呈三棱柱体(如图所示)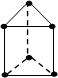
(1)写出该烃的分子式
(2)该烃的一氯取代物是否有同分异构体
(3)该烃的二氯取代物有多少种
(4)该烃的同分异构体有很多种,其中1种不能使酸性高锰酸钾溶液或Br2-CCl4溶液褪色,但在一定条件下能跟溴(或H2)发生取代(或加成)反应,这种同分异构体的结构简式是
苹果酸(HOOC—CHOH—CH2COOH)常用于汽水、糖果的添加剂,
写出苹果酸分别与下列物质反应的化学方程式
①Na
②CH3CH2OH(H2SO4,△)
现有5种有机物:①乙烯,②乙醇,③乙醛,④乙酸,⑤乙酸乙酯。
(1)请分别写出其中含有下列官能团的有机物的结构简式
①-OH________ ②-CHO________ ③-COOH________
(2)在上述5种有机物中(填写序号)
①能发生银镜反应的是。
②能发生水解反应的是
③具有酸性且能发生酯化反应的是
④既能发生加成反应,又能发生聚合反应的是
(14分)为测定NaOH溶液的浓度,实验如下:用标准稀盐酸溶液进行滴定
(1)配制100 mL 0.1000mol·L-1盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要
(2)用量取20.00 mL待测NaOH溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取NaOH溶液体积均为20.00 mL,三次实验结果如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗盐酸溶液体积/mL |
19.00 |
23.00 |
23.04 |
该NaOH溶液的浓度约为____________________
(3)滴定时边滴边摇动锥形瓶,眼睛 ______
(4)下列操作会造成测定结果(待测NaOH溶液浓度值)偏低的有_____
A. 配制标准溶液定容时,加水超过刻度 B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用标准稀盐酸溶液润洗
D. 滴定到达终点时,俯视读出滴定管读数;
E. 酸式滴定管尖嘴部分有气泡,滴定后消失
F. 摇动锥形瓶时有少量液体溅出瓶外
(5)画出滴定过程中锥形瓶内溶液的pH随滴入标准盐酸溶液体积的变化曲线
(6)中和滴定的装置和相似操作来做其它实验,如据反应I2 + 2S2O32- = 2I- +S4O62-可以用碘水滴定Na2S2O3溶液,应选_作指示剂;据反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2+2MnSO4+8H2O可以用酸性KMnO4溶液滴定H2C2O4溶液,KMnO4溶液应装在_______滴定管中。