某学习小组用题图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
(1)中试剂为.

(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是.
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录的液面位置;②将中剩余固体过滤,洗涤,干燥,称重;③待中不再有气体产生并恢复至室温后,记录的液面位置;④由向中滴加足量试剂;⑤检查气密性,上述操作的顺序是;(填序号)记录的液面位置时,除视线平视外,还应.
(4)中发生反应的化学方程式为
(5)若实验用铝镁合金的质量为,测得氢气体积为(已换算为标准状况),中剩余固体的质量为,则铝的相对原子质量为.
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将.(填"偏大"、"偏小"、"不受影响")
现有下列四组溶液,每组包括三种溶液并按A、B、C顺序排列:
甲乙丙丁
A.BaCl2Na2CO3KClK2CO3
B.硝酸硝酸盐酸盐酸
C.Na2CO3AgNO3K2CO3BaCl2
请根据下列操作中所观察的现象完成下列问题:
向CaCl2溶液中加入A溶液产生白色沉淀;继续加入过量的B溶液沉淀消失,并产生无色无味的气体;再加入少量的C溶液,又生成白色沉淀。
(1)上述操作过程中,选用了组溶液。
(2)有关反应的离子方程式是。
有一包白色粉末,取出少量溶于水,用铂丝蘸取少许溶液,在无色火焰上灼烧,火焰呈黄色,若透过蓝色钴玻璃观看,则呈浅紫色。另取少量粉末加热,没有气体产生,但加入稀盐酸后,则有无色无味的气体生成,此气体能使澄清石灰水变浑浊,继续加稀盐酸至过量后,再加入硝酸钡溶液,出现白色沉淀。试问:白色粉末中肯定含有哪几种离子?写出上述变化的离子方程式。
某碱金属的氧化物中含氧29%,其相对分子质量为110,则其化学式为,它与CO2反应的化学方程式为。
图中A是一种碱金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式: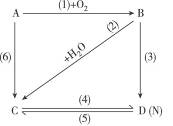
A__________;B_______________;C_______________;D______________。
(1)__________________(2) _____________________(3) ___________________________;
(4) __________________(5)_____________________(6) _______________________。
现有A、B、C、D四种化合物,透过蓝色钴玻璃其焰色反应均为紫色,A、B、C和盐酸发生反应后,均得到D;将固体C加热可得到A;若在A的溶液中通入一种无色无味气体,可制得C;若B与C的溶液混合可制得A。推断:
A为 ;B为 ;
C为 ;D为 。
写出有关反应的化学方程式:。