将PH=1的稀硫酸慢慢加入一定量的BaCl2溶液中,恰好使Ba2+沉淀完全,此时溶液的体积为100mL(混合时溶液体积变化忽略不计),PH为2,则原BaCl2溶液Cl-的浓度为
| A.0.011 mol·L-1 | B.0.22 mol·L-1 | C.0.022 mol·L-1 | D.0.11 mol·L-1 |
对铜—锌—稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是①锌片溶解了32.5克 ②锌片增重了32.5克 ③铜片上析出1克氢气④铜片上析出1mol氢气
| A.①③ | B.①④ | C.②③ | D.②④ |
下列用水就能鉴别的一组物质是
| A.苯、己烷、四氯化碳 | B.苯、乙醇、四氯化碳 |
| C.硝基苯、乙醇、四氯化碳 | D.硝基苯、乙醇、乙酸 |
把100mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的
| A.硫酸铜溶液 | B.硝酸钠溶液 | C.醋酸钠溶液 | D.氢氧化钠溶液 |
下列说法中正确的一组是
| A.H2和D2互为同素异形体; |
B.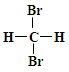 和 和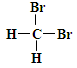 互为同分异构体; 互为同分异构体; |
| C.正丁烷和异丁烷是同系物; |
D.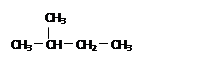 和 和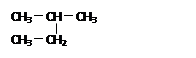 是同一种物质 是同一种物质 |
在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合绿色化学原子经济要求的是
| A.乙烯聚合为聚乙烯高分子材料 | B.甲烷与氯气制备一氯甲烷 |
| C.以铜和浓硝酸为原料生产硝酸铜 | D.用二氧化硅制备高纯硅 |