2008年诺贝尔化学奖授予日本科学家下村修、美国科学家马丁·沙尔菲与美籍华裔科学家钱永健,以表彰三人因在发现和研究绿色荧光蛋白方面做出的贡献。蛋白质是一类复杂的含氮化合物,每种蛋白质都有其恒定的含氮量(质量分数约在14%--18%),蛋白质是人体重要营养物质之一,2008年9月“三鹿牌婴幼儿奶粉事件”中,由于在低蛋白含量的奶粉中加入三聚氰胺来“提高”奶粉中的蛋白质含量,导致许多婴幼儿肾结石。三聚氰胺目前由尿素加热分解制得,生产成本价廉,三聚氰胺的结构如图所示。
食品中蛋白质含量的现行国家标准和国际通行测定方法是经典凯氏定氮法,其测定原理是:
Ⅰ.有机物中的氮在强热和CuSO4、浓H2SO4作用下,生成(NH4)2SO4
Ⅱ.(NH4)2SO4与碱作用,蒸馏释放出NH3,收集于H3 BO3溶液中,生成 (NH4)2B4 O7
Ⅲ.用已知浓度的HCl标准溶液滴定,根据HCl消耗的量计算出氮的含量,再换算出蛋白质的含量。乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%。
(1) 用尿素制备三聚氰胺的化学方程式为: _________________________。
上述原理第Ⅱ步生成(NH4)2B4 O7的离子方程式为:_________________________。
(2)凯氏定氮法在测定奶粉中蛋白质含量时,为什么会失真?
__________________________________________________。
(3)下列关于三聚氰胺的说法中,正确的有_____;
| A.三聚氰胺是一种白色结晶粉末,没有气味,所以掺入奶粉后不易被发现 |
| B.三聚氰胺属于芳香族化合物。 |
| C.三聚氰胺不溶于水,属于分子晶体 |
| D.三聚氰胺呈弱碱性,可以和酸反应生成相应的盐 |
E、三聚氰胺可以发生取代反应
F、三聚氰胺分子中所有原子可能在同一个平面上
G、1mol三聚氰胺可以与3mol氢气发生加成反应
(4)三聚氰胺含氮量(氮元素的质量分数)为____;假定奶粉中蛋白质含量为16%即为合格,三鹿牌婴幼儿配方乳粉抽查结果显示其三聚氰胺含量为2563.00mg/kg,三鹿牌婴幼儿配方乳粉蛋白质含量实际上是____;掺假百分率为____。
(12分)
雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。
(1)元素第一电离能:Al ▲Mg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: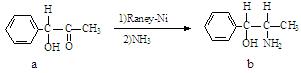
化合物b中进行sp3杂化的原子有: ▲。
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是: ▲(选填序号)。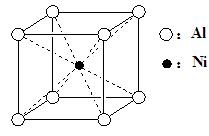
a.氯化钠b.氯化铯c.石英d.金刚石
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
①Ni2+在基态时,核外电子排布式为: ▲。
②在配合物中用 化学键和氢键标出未画出的作用力(镍的配位数为4)。
化学键和氢键标出未画出的作用力(镍的配位数为4)。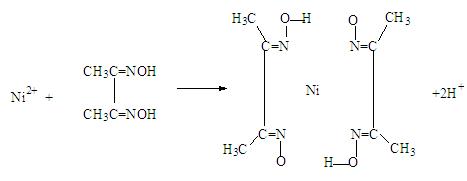
β-拉帕醌(β-lapachone)是一种抗癌新药,合成路线如下: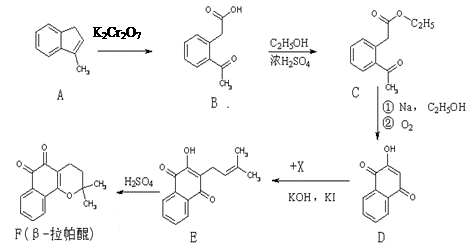
(1)已知X的分子式为C5H9Cl,则X的结构简式为: ▲。
(2)反应类型A→B ▲。
(3)上述反应中,原子利用率达100%的是 ▲(选填:“A→B”、“B→C”、“D→E”、“E→F”)。
(4)D→E发生的是取代反应,还有一种副产物与E互为同分异构体,且属于醚类,该物质的结构简式为: ▲。
(5)化合物B的同分异构体很多,满足下列条件的同分异构体数目有 ▲种(不包括立体异构)。
①属于苯的衍生物②苯环上有两个取代基
③分子中含有一个手性碳原子④分子中有一个醛基和一个羧基
(6)已知:双烯合成反应: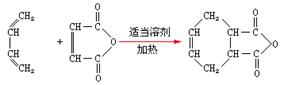 ,试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子
,试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子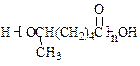 。
。
[提示]合成路线流程图示例如下:
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4] ―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
[方法一]还原法在酸性介质中 用FeSO4等将+6价铬还原成+3价铬。
用FeSO4等将+6价铬还原成+3价铬。
具体流程如下: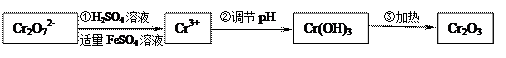
有关离子完全沉淀的pH如下表:
| 有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
| 完全沉淀为对应氢氧化物的pH |
9.0[ |
3.2 |
5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 ▲。
▲。
(2)还原+6价铬还可选用以下的 ▲试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。则在操作②中可用于调节溶液pH的试剂为: ▲(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在 ▲(填序号)最佳。
A.3~4  B.6~8 C.10~11 D.12~14
B.6~8 C.10~11 D.12~14
[方法二]电解法将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极 的电极反应式 ▲。
的电极反应式 ▲。
(5)电解法中加入氯化钠的作用是: ▲。
尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l)△H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l)△H=-103.7 kJ·mol-1
试回答下列问题:
(1)下列措施中有利于提高尿素的产率的是 ▲。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l)△H1
H2NCOONH4(氨基甲酸铵) (l)△H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)△H2
H2O(l)+H2NCONH2(l)△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,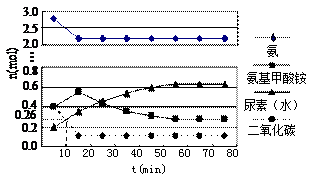

图Ⅰ图Ⅱ
实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 ▲步反应决定,总反应进行到 ▲min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= ▲。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 ▲0(填“>”“<”或“=”)
综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示: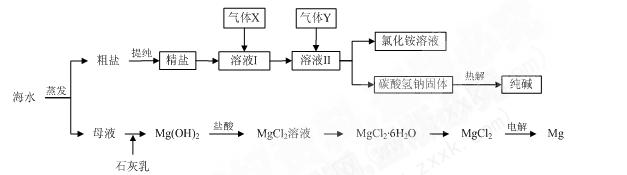
(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO 3溶液;⑤ ▲;⑥加适量的盐酸;⑦ ▲。
3溶液;⑤ ▲;⑥加适量的盐酸;⑦ ▲。
(2)溶液Ⅱ中发生反应的化学方程式是: ▲。
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用 ▲溶液进行洗涤以除之。
(4)高温灼烧六水 合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式 ▲。
合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式 ▲。
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为: ▲。