已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4] ―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
[方法一]还原法在酸性介质中 用FeSO4等将+6价铬还原成+3价铬。
用FeSO4等将+6价铬还原成+3价铬。
具体流程如下: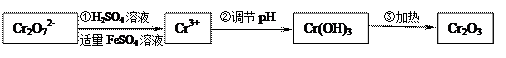
有关离子完全沉淀的pH如下表:
| 有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
| 完全沉淀为对应氢氧化物的pH |
9.0[ |
3.2 |
5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式  ▲ 。
▲ 。
(2)还原+6价铬还可选用以下的 ▲ 试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。则在操作②中可用于调节溶液pH的试剂为: ▲ (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在 ▲ (填序号)最佳。
A.3~4  B.6~8 C.10~11 D.12~14
B.6~8 C.10~11 D.12~14
[方法二]电解法将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极 的电极反应式 ▲ 。
的电极反应式 ▲ 。
(5)电解法中加入氯化钠的作用是: ▲ 。
已知N、P同属于元素周期表的第VA族元素,N在第2周期,P在第3周期。NH3
分子呈三角锥形,氮原子位于锥顶,三个氢原子位于锥底,N—H键间的夹角是107°。
(1)PH3分子与NH3分子的构型关系是________(填“相同”或“相似”或“不相似”),P—H______极
性(填“有”或“无”),PH3分子________极性(填“有”或“无”)。
(2)NH3与PH3相比,热稳定性________(填化学式)更强。
(3)NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是________.
| A.键的极性N—H比P—H强 | B.分子的极性NH3比PH3强 |
| C.相对分子质量PH3比NH3大 | D.NH3分子之间存在特殊的分子间作用力 |
单质硼有无定形和晶体两种,参考下表数据
晶体硼的晶体类型属于晶体,理由是
现有甲、乙、丙(如下图》三种晶体的晶胞:(甲中x处于晶胞的中心,乙中a处于
晶胞的中心),可推知:甲晶体中x与y的个数比是__________,乙中a与b的个数比是__________,丙晶胞中有_______个c离子,有____________个d离子。
在HF、H2O、NH3、CS2、CH4、N2、BF3分子中:
(1)以非极性键结合的非极性分子是________;
(2)以极性键结合的具有直线形结构的非极性分子是________;
(3)以极性键结合的具有正四面体形结构的非极性分子是________;
(4)以极性键结合的具有三角锥形结构的极性分子是________;
(5)以极性键结合的具有sp2杂化轨道结构的分子是________。
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下: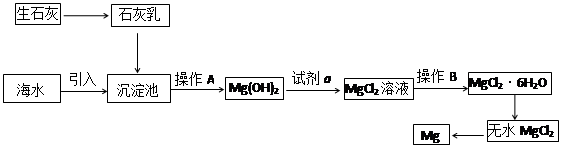
请回答下列问题:
⑴从离子反应的角度思考,在海水中加入石灰乳的作用是 。
⑵石灰乳是生石灰与水形成的混合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 。
⑶操作A是 , 操作B是 。
⑷无水MgCl2在熔融状态下,通电后会生成Mg和Cl2,该反应的化学方程式是。从考虑成本和废物循环利用的角度,副产物氯气可以用于 。
⑸海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
。