CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径。
⑴下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的有______(填字母)。
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
⑶有学者设想以右图所示装置用电化学原理将CO2、SO2转化为重要化工原料。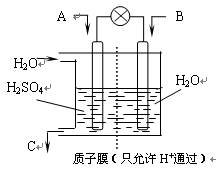
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为 。
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟从C处获得100mL10mol/LH2SO4,则A处通入烟气(SO2的体积分数为1%)的速率为 L/min(标准状况)。
(10分)A—K是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,G、H为气态单质,I在常温下为液体,D、E、F的水溶液均呈碱性,由C的饱和溶液制取F或E是重要的化工生产。回答下列问题:
(1)写出下列物质的化学式:C________E_______
(2)写出下列反应的化学方程式: B D:_______________________________
B D:_______________________________ C E:_______________________________
C E:_______________________________
(3)画出F的电子式:________________
(4)常温下若电解1L C的饱和溶液,当电路中通过0.1mol电子时,溶液的pH值(假设溶液体积不变)为_________。
(8分) KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为: KClO3 +
KClO3 + HCl(浓)=
HCl(浓)= KCl +
KCl + ClO2↑+
ClO2↑+ Cl2↑+
Cl2↑+

⑴请完成该化学方程式并配平(未知物化学式和系数填入框内)
⑵浓盐酸在反应中显示出来的性质是_______(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
⑶产生0.1molCl2,则转移的电子的物质的是为_________mol。
⑷ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的倍。
(7分)某河道两旁有甲、乙两厂,它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的3种离子是________、________、________。
(2)乙厂的废水中含有另外3种离子,如果加一定量________(填“活性炭”“硫酸亚铁”或“铁粉”)可以回收其中的金属________(填写金属元素符号)。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的__________
(填写离子符号)转化为沉淀,经过滤后的废水主要含________,可用来浇灌农田。
.X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
⑴M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,B的结构式为_______。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
现有四种试剂:①新制Cu(OH)2悬浊液;②浓硝酸;③AgNO3溶液;④碘水。
为了鉴别下列四瓶无色溶液,请你选择合适的试剂,将其序号填入相应的括号中。
(1)葡萄糖溶液(2)食盐溶液
(3)淀粉溶液(4)鸡蛋清溶液