二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:



①将干燥的氯气在110 ℃~140 ℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
| S |
112.8 |
444.6 |
略 |
| S2Cl2 |
-77 |
137 |
 遇水生成HCl、SO2、S;300 ℃以上完全分解:S2Cl2+Cl2 2SCl2 遇水生成HCl、SO2、S;300 ℃以上完全分解:S2Cl2+Cl2 2SCl2 |
设计实验装置图如下:
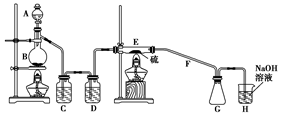 |
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见 。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式: ;
E中反应的化学方程式: 。
(3)C、D中的试剂分别是 、 。
(4)仪器A、B的名称分别是 、 ,
F的作用是 。
(5)如果在加热E时温度过高,对实验结果的影响是 ,在F中可能出现的现象是 。
(6)S2Cl2粗品中可能混有的杂质是(填写两种) 、 ,为了提高S2Cl2的纯度,关键的操作是控制好温度和 。
(1)A元素原子的核电荷数为8,其原子核内的质子数为________,该元素原子的二价阴离子中,核外电子数为________,中子数是9的核素表示为________。
(2)B元素原子的一价阳离子的核外有18个电子,质量数为40,该元素原子的原子核内中子数为________。
(3)A、B形成1∶1型化合物的相对分子质量是________。
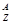 X表示原子:
X表示原子:
(1)中性原子的中子数N=______。
(2)AXn+共有x个电子,则该阳离子的中子数N=______。
(3)AXn-共有x个电子,则该阴离子的中子数N=______。
(4)12C16O2分子中的中子数N=________。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为________。
(1)向NaBr和KI的混合溶液中,通入足量的Cl2后,将溶液蒸干并灼烧,最后蒸发皿中剩余的物质是________,写出反应的化学方程式:________________________________。
(2)向KI溶液中滴入淀粉溶液,现象是____________________,再滴入氯水,现象是________,有关反应的离子方程式为______________________。
甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位于第________周期;乙元素在周期表中位于第________族;丙元素的名称为________。
(2)甲的单质与水反应的离子方程式为____________________________;
乙单质与丙单质反应的化学方程式为______________________________。
下表为元素周期表的一部分。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 一 |
① |
||||||
| 二 |
② |
③ |
④ |
⑤ |
⑥ |
||
| 三 |
⑦ |
⑧ |
⑨ |
⑩ |
|||
| 四 |
⑪ |
⑫ |
⑬ |
(1)表中元素________的非金属性最强;元素________的金属性最强;元素________的单质室温下呈液态(填写元素符号);
(2)表中元素⑦的原子结构示意图为_____________________;
(3)表中元素⑥⑩氢化物的稳定性顺序为________>________(填写化学式,下同);
(4)表中元素⑩和⑬最高价氧化物对应水化物的酸性:
________>________。
(5)表中元素②和⑦最高价氧化物对应水化物的碱性________>________。