W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W ,X ,Y ,Z 。
(2)XY分子中,X原子与Y原子都达到8电子稳定结构,则XY分子中X和Y原子用于成键的电子数目分别是 ;根据电子云重叠方式的不同,分子里共价键的主要类型有 。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是:
。
以节能减排为基础的低碳经济已成为实现人类可持续发展的重要课题。
(1)控制和治理CO2是解决温室效应的有效途径,其中一种途径是将CO2转化成有机物实现碳循环。如2CO2(g)+2H2O(1)C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(1)C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由C2H5OH(1)转化为C2H4(g)和H2O(1)的热化学方程式为。
(2)为探究反应6H2(g)+2CO2(g)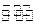 CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
根据表中实验数据分析:
①该反应的正反应为(填“吸热”或“放热”)反应。
②为提高CO2的平衡转化率,可采取的措施有(写出一条即可)。
(3)一定条件下,将3 mol H2和1mol CO2气态混合物充入2L密闭容器中,发生如下反应:3H2(g)+CO2(g)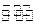 CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是。
CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是。
A.该反应的平衡常数表达式为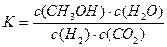 |
| B.CO2的平衡转化率为40% |
| C.2min内H2的平均反应速率为0.3mol/(L·min) |
| D.该反应达到平衡状态的标志是混合气体的密度不发生改变 |
(4)右图是甲烷燃料电池的工作原理示意图,电解质溶液为KOH溶液。则负极室通入的气体是(填“甲烷”或“氧气”);正极室电极上发生的电极反应是;其电池的总反应为。比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是能量转化效率高,其次是。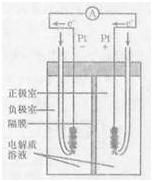
某固体混合物可能由SiO2、Fe2O3、A12O3、Na2SO3、Na2CO3中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如下图所示: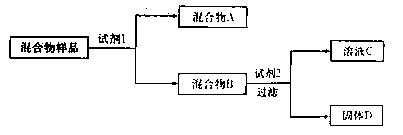
请回答下列问题:
(1)若试剂1是稀硫酸,试剂2是氢氧化钠溶液。在混合物样品中加以足量的稀硫酸后,固体全部溶解,得到混合气体A和澄清溶液B,在B中滴加过量氢氧化钠溶液时,先有沉淀生成,后沉淀部分溶解。则该混合物样品中一定不含的物质是;固体D的化学式为;检验混合物B中含有Fe3+所选用的试剂是;证明混合气体A中含有CO2的实验方法是。
(2)若试剂1是水,试剂2是氢氧化钠溶液(过量)。在混合物样品中加足量的水后过滤,混合物B是滤渣,试推断:固体D的化学式为;检验溶液C中是否含有SiO32—的实验方法是。
某混合物A ,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中 对于溶液和沉淀的分离采取的方法是。
对于溶液和沉淀的分离采取的方法是。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
固体B;沉淀C;沉淀D;溶液E。
(3)写出①、③、④三个反应方程式和②离子方程式。
① ____;② _____;
③ ____ ;④ ___。
主族元素A、B、C、D都是短周期元素,A、D同主族,B、C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体。它们在一定条 件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。
件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。
回答下列问题:(1)写出元素符号A____,B____,C____,D____。
(2)写出B单质与D在加热反应后生成物质的化学式___________ ___________。
___________。
写出符合下列条件的短周期元素.(提示:答案可能有多种) (6分)
①.最外层电子数是次外层电子数的1/2的元素.___________ (填元素符号,下同)
②.最外层有2个电子的元素_________________
③.M层电子数是L层电子数的3/4的元素_____________