在一容积为2 L的密闭容器内加入0.2 molA和0.6 molB,在一定条件下发生反应:A(s)+3B(g) 2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
64.0 |
50.7 |
42.9 |
请回答下列问题:
⑴该反应的平衡常数表达式K= ,ΔH 0(填“>”或“<”)。
⑵1000 ℃时,4 min后达到平衡.求4 min内D的平均反应速率v(D)= ,B的平衡转化率为 ,平衡时B的体积分数 。
⑶欲提高⑵中B的平衡转化率,可采取的措施是
A.减少C的量 B.增加A的量 C.移出部分D
D.降低反应温度 E.减小容器的容积 F.加入合适的催化剂
⑷1000 ℃时, 在一容积为2 L的密闭容器内加入XmolC和0.6 molD,5 min后达到平衡,B的浓度与⑵中B的浓度相同,求X的范围
⑸下列说法中能说明反应已达到平衡状态的是
A.容器内混合气体的压强不随时间变化而变 B.B的速率不随时间的变化而变化
C.c(B)︰c(D)=1︰1 D.混合气体的密度保持不变(M(B)≠M(D))
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。指出电解质溶液是__________,正极电极反应式为__________________。
(3)写出甲醇(CH3OH)—空气碱性燃料电池(KOH作为电解质溶液)的负极反应式:_______________________________。
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序。
(2)ZW2的电子式是。
(3)实验室制备Y的最高价氧化物的水化物的离子方程式是
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是
(5)0.1mol的单质W与50mL 1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是。
在下列各元素组中,除一种元素外,其余都可以按某种共性归属一类。请选出各组的例外元素,并将该组其他元素的可能归属按所给6种类型的编号填入表内。
| 元素组 |
例外元素 |
其他元素所属类型编号 |
| ⑴S、N、Na、Mg |
||
| ⑵P、Sb、Sn、As |
||
| ⑶Rb、B、Te、Fe |
归属类型:①主族元素②过渡元素③同周期元素④同族元素
⑤金属元素⑥非金属元素
BaSO4在水中存在沉淀溶解平衡BaSO4(s) Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。
Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。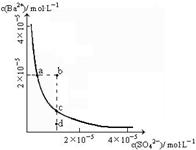
(1)某温度时,BaSO4的沉淀溶解平衡曲线如图所示。下列说法正确的是______
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
(2)在胃部透视时,服用的“钡餐”的主要成分是硫酸钡。在25℃时,硫酸钡的溶度积常数约为1.21×10—10。
①Ba2+是一种有毒的重金属离子,当人体中c(Ba2+)达到2×10—3mol·L-1时,就会对健康产生危害。硫酸钡作为“钡餐”的理由。
②在25℃时,1L水中约能溶解0.0197g碳酸钡,且胃液是酸性的,(填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”,理由是
(1)AgNO3的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。
(2)醋酸钠水溶液PH7 ,(填“>”、“=”、“<”)原因是(用离子方程式表示):______。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(3)氯化铵溶液中滴加适量氨水,至溶液呈中性,则c(Cl-)c(NH4+)(填“>”、“=”、“<”)。(4)在25℃下,某浓度Na2CO3溶液中由水电离出来c(OH-)=1×10-6 mol/L,则此溶液的PH值为