在下列各元素组中,除一种元素外,其余都可以按某种共性归属一类。请选出各组的例外元素,并将该组其他元素的可能归属按所给6种类型的编号填入表内。
| 元素组 |
例外元素 |
其他元素所属类型编号 |
| ⑴S、N、Na、Mg |
|
|
| ⑵P、Sb、Sn、As |
|
|
| ⑶Rb、B、Te、Fe |
|
|
归属类型:①主族元素 ②过渡元素 ③同周期元素 ④同族元素
⑤金属元素 ⑥非金属元素
软锰矿的主要成分是,实验室常用该主要成分与浓盐酸反应制氯气,其反应的离子方程式是,该反应中浓盐酸的作用是,常用的吸收处理多余氯气的方法中涉及的反应的离子方程式是。
实验室配制500mL 0.2mol/L Na2SO4溶液,所需仪器有;若实验操作中某同学在加蒸馏水至刻度线时仰视观察确定蒸馏水的加入量,则所配溶液浓度(选填“ 偏高”“偏低”或“无影响”)。
偏高”“偏低”或“无影响”)。
下图中,已知B溶液能使酚酞试液变红,且焰色反应呈黄色;下图中气体E在气体G中燃烧产生苍白色火焰,D、F相遇会产生白烟。请按要求填空: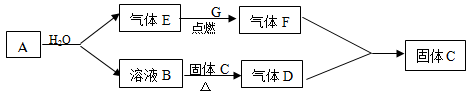
(1) A的名称是 ;F的化学式是。
;F的化学式是。
(2) B→D反应的化学方程式。
某无色混合气体可能含有Cl2、O2、HCl、NH3、NO、NO2中的两种或多种,将此混合气体经过浓硫酸后体积明显减少,将剩余气体排入空气中,很快变成红棕色。则原混合气体中:肯定含有,肯定不含有。
干燥的氨气可与等液体物质(至少选填两种)一起组装成功喷泉实验;向烧杯中的FeSO4溶液中滴加NaOH溶液,然后烧杯静置在空气中,可观察到的现象是;有关反应的化学方程式或离子方程式为:
①②;
向新制氯水中滴加AgNO溶液,现象是,相应的离子方程式为
①②;