三种短周期元素X、Y、Z,它们的原子序数之和为16,X、Y、Z三种元素的常见单质在常温下都是无色气体。已知X原子的最外层电子数是内层电子数的3倍,X和Y的单质直接化合形成气体A,X和Z的单质直接化合形成液态化合物B,Y和Z的单质直接化合形成的化合物C是一种无色有刺激性气味的气体。
请回答下列问题:
(1)Y元素在周期表中的位置是 。
(2)C可在X的单质中燃烧得到Y的单质和化合物B,利用此反应可制成新型的化学电源(KOH溶液做电解质溶液),两个电极均由多孔碳制成,通人的气体由孔隙中逸出,并在电极表面放电,则正极通入的物质是 (填物质名称);负极的电极反应式为 。
(3)C与X的单质反应生成A的化学方程式为 。
(4)常温下,C的水溶液的pH=12,则该溶液中由水电离的C(OH-)= 。若向C溶液中加入等体积、等物质的量浓度的盐酸,所得溶液中水的电离程度 (填“大于”、“等于”或“小于”)相同条件下C溶液中水的电离程度。
(5)在2L密闭容器中放入1molC气体,在一定温度进行如下反应:
2C(g)  Y2(g)+3Z2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
Y2(g)+3Z2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min |
0 |
1 |
2 |
3 |
4 |
5 |
| 总压强P l00 kPa |
4 |
4.6 |
5.4 |
5.8 |
6 |
6 |
该反应的化学平衡常数表达式是 (用具体物质的化学式表示);平衡时C的转化率为 。
(6)已知:①Y2(g)+2X2(g)=2YX2(g)  H=+67.7 kJ·mol-1。
H=+67.7 kJ·mol-1。
②Y2Z4(g)+X2(g)=Y2(g)+2Z2X(g)  H="-534" kJ·mol-1。
H="-534" kJ·mol-1。
则2Y2Z4(g)+2YX2(g)=3Y2(g)+4Z2X(g)  H= kJ·mol-1
H= kJ·mol-1
乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明正确的是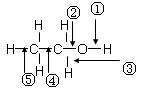
⑴和金属 钠作用时,断裂键______
钠作用时,断裂键______
⑵和浓硫酸共热至170 ℃时,断裂键______
⑶ 和乙酸、浓硫酸共热时,断裂键_______
和乙酸、浓硫酸共热时,断裂键_______
⑷在铜催化下和氧气反应时,断裂键_____
⑸与氢卤酸反应时,断裂键______
现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池AB(填能或不能)
(2)如果可以,在方框中画出其原电池装置图,在图上标明正负极、电子流动方向,并写出正、负极材料及其电极反应式,电解质溶液名称
正极材料,电极方程式;
负极材料,电极方程式;
电解质溶液名称。
下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ)。这一数据的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差。
| 化学键 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
| 能量(kJ) |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
回答下列问题:
(1)在HCl、HBr、HI中,最稳定的是__________;
(2)对于反应X2 + H2=2HX(X2代表Cl2、Br2、I2),相同条件下,消耗等量氢气时,放出热量最多的是__________;
(3)反应Br2 + H2=2HBr,当生成1mol HBr时放出_________ kJ能量。
(14分)主族元素A、 B、C、D的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在高温下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能激烈反应生成A的单质。所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。回答下列问题:
B、C、D的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在高温下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能激烈反应生成A的单质。所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。回答下列问题:
⑴写出元素符号A, D。
写出B阴离子结构示意图;
写出C元素在周期表中的位置第周期族;
⑵写出C在足量B中充分反应后生成物的电子式,结构式。
⑶写出B、D在加热条件下形成化合物的电子式,
判断其中的化学键的类型。
用电子式表示B、D在不加热条件下形成化合物的形成过程。
⑷写出一种有A、B、C、D组成的化合物的化学式。
有H、D、T三种原子它们之间的关系是________。各1mol的H2、D2、T2三种单质中质子数之比是_________;在标准状况下,1L各种单质中它们的电子数之比是________,在标准状况下它们的单质的密度之比是____________。