反应aA(g) +bB(g) cC(g)+d D(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b。则

(1)平衡时A与B的转化率之比是 。
(2)若同等倍数地增大A、B的物质的量浓度,要使A与B的转化率同时增大,(a+b)与(c+d)所满足的关系是(a+b) (c+d ) (填“>”“=”“<”或“没关系”)。
(3)设定a="2" ,b=1,c=3,d=2,在甲、乙、丙、丁4个相同的容器中A的物质的量依次是2 mol、1 mol、2 mol、1 mol,B的物质的量依次是1 mol、1 mol、2 mol、2 mol,C和D的物质的量均为0。则在相同温度下达到平衡时,A的转化率最大的容器是 ,B的转化率由大到小的顺序是 (填容器序号)。
X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。
用化学用语回答下列问题:
(1)L的元素符号为___________;M在元素周期表中的位置为__________________。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是______________。
(3)Y的最高价氧化物的电子式为__________。原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________。
(4)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是_____________。
下图是硫酸试剂瓶标签上的内容:
(1)该硫酸的物质的量浓度是 mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol/L的稀H2SO4,则需要取 mL的该硫酸,将上述硫酸进行稀释的实验操作为 。
(3)在配制4.6 mol/L稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)。
①未经冷却趁热溶液注入容量瓶中: 。
②容量瓶用1mol/L稀H2SO4润洗: 。
③定容时仰视观察液面 。
(4)常温下,某学生取出少量试剂瓶中的硫酸于一洁净试管中,加入几片铝,结果铝片表面没有气泡产生,也未发现铝片溶解,试帮助该同学分析其原因 。
O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为__________,原子个数比为__________。
(2)等温等压下,等体积的O2和O3所含分子个数比为____ ,原子个数比为______,质量比为________。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是________ (用含NA的式子表示)。
①~⑩十种元素,在元素周期表中的位置如图所示。回答下列问题: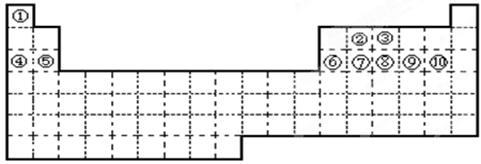
(1)在上述十种元素中,置换酸中氢的能力最强的元素为 (填化学符号,下同);最高价氧化物的水化物的酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ;原子半径最大的元素是 ,半径最小的离子是 。
(2)上述十种元素中,金属性最强的元素在周期表中的位置是第 周期 族,该元素的单质在空气中燃烧的化学方程式为 。
(3)试用电子式表示元素①和③形成分子的过程 。
短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请回答:
(1)X元素是________;Y元素是________;Z元素是:________。
(2)XZ3化合物的分子式是_________,电子式是_________。
(3)分别写出X、Y的含氧酸的分子式_________、_________。