设 表示阿伏加德罗常数,下列有关说法正确的是
表示阿伏加德罗常数,下列有关说法正确的是
A.1 mol 见光分解,转移电子数 见光分解,转移电子数  |
B.28g乙烯与28g丙烯中均含有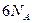 对共用电子对 对共用电子对 |
C.合成氨反应,当断裂3 个H—H键的同时生成6 个H—H键的同时生成6 个N—H键,则该反应达到平衡状态 个N—H键,则该反应达到平衡状态 |
D.7.8g 含有的阴离子数目为0.2 含有的阴离子数目为0.2  |
合成氨所需的氢气可用煤和水作原料经过多步反应制得,其中的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )。
CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )。
| A.增加压强 | B.降低温度 | C.增大CO的浓度 | D.更换催化剂 |
固体电解质通过其中的离子迁移进行电荷传递,因此又称为固体离子导体,RbAg4I5晶体就是一种重要的固体电解质,其中发生迁移的物质全是Ag+。利用RbAg4I5晶体,可以制成电化学气敏传感器,如图是一种测定O2含量的气体传感器示意图。被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势的变化可以得知O2的含量。在气体传感器的工作过程中,下列变化肯定没有发生的是 ( )。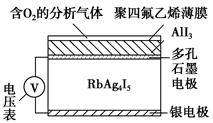
| A.I2+2Rb++2e-=2RbI |
| B.I2+2Ag++2e-=2AgI |
| C.Ag-e-=Ag+ |
| D.4AlI3+3O2=2Al2O3+6I2 |
镁燃料电池作为一种高能化学电源,具有良好的应用前景。如图是镁-空气燃料电池工作原理示意图。下列有关该电池的说法正确的是 ( )。
| A.该电池Mg作负极,发生还原反应 |
| B.该电池的正极反应式为O2+2H2O+4e-=4OH- |
| C.电池工作时,电子通过导线由碳电极流向Mg电极 |
| D.当电路中通过0.2 mol电子时,消耗的O2体积为1.12 L |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。以下说法正确的是 ( )。
| A.电池工作时,MnO2失去电子 |
| B.电池工作时,电子由锌经外电路流向MnO2 |
| C.从反应方程式来看,不使用氢氧化钾,也不影响电流大小 |
| D.电池的正极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) |
如图是某二次电池充、放电时的工作示意图,已知放电时电池反应为Zn+Ag2O+H2O=2Ag+Zn(OH)2。下列有关说法正确的是( )。
| A.放电时的负极反应和充电时的阴极反应属于可逆反应 |
| B.在电池放电过程中溶液的pH增大 |
| C.K与N相接时,能量由化学能转化为电能,溶液中的OH-向正极区移动 |
| D.K与M连接时,所用电源的a极为负极,阳极附近溶液的pH逐渐增大 |