同浓度的下列溶液中NH4+的浓度的由大到小顺序为
①NH4HSO4 ②(NH4)2SO4 ③(NH4)2Fe(SO4) ④NH4HCO3 ⑤(NH4)2CO3
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题: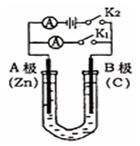
(1)打开K2,合并K1,若所盛溶液为CuSO4溶液:则A为极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是,Na+移向极(填A、B);B电极上的电极反应式为,总反应化学方程式是 。
(3)如果要用电解的方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 (填“粗铜”或“纯铜”),电极反应式是 ,反应一段时间后电解质溶液中Cu2+的浓度将会(填“增大”、“减小”、“不变”)。
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程式为:。
(2)今有如下两个热化学方程式:则ab(填“>”、“=”或“<”)
H2(g)+ 1/2O2(g)=H2O(g)ΔH1=a kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l)ΔH2=b kJ·mol-1
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 |
H-H |
N-H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2(g)+3H2(g)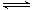 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ;
CH3OCH3(g) + CO2 (g)的ΔH= ;
(每空2分,共12分)实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案: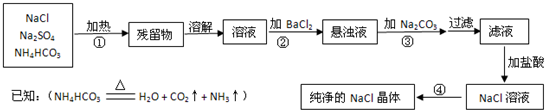
请回答下列问题:
(1)操作①加热的目的是______,发生的反应______(填“是”或“不是”)氧化还原反应.
(2)操作②除用BaCl2溶液外,还可以用______.
(3)操作③的目的是_____,发生反应的方程式为:.
(4)操作④应在(填仪器名称)中进行.
每空2分,共10分)
(1)标准状况下,体积为11.2 L 的CO2的物质的量为mol,质量为g,其所含原子的总数为。
(2)某金属氯化物为MCl29.5g,含有0.200molCl-,则该氯化物的摩尔质量,金属M的相对原子质量为。
(每空2分,共10分)在同温同压下,对于等质量的SO2和CO2两种气体,求其下列各项比值。
(1)摩尔质量比__(2)密度比__(3)物质的量比__(4)体积比___(5)分子数比__