A、B、C、D 四种短周期元素,原子序数依次增大, A 原子的最外层上有 5 个电子; B 的阴离子和 C 的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体 E , D 的L 层电子数等于 K、M 两个电子层上的电子数之和。 ( 1 ) A 的最高价氧化物的水化物是___________(填化学式);
( 2 )物质 E 中所包含的化学键有______________,写出 C、D 两元素形成的化合物 C2D 的电子式______________________;
( 3 )把盛有 48mL AB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为 24 mL,则原混合气体中 AB 的体积分数为__________。
(每空 2 分,共 8 分)
(每空2分共计8分)A、B、C、D四种可溶性盐,它们的阳离子分别是Ba2+、Ag+、Na+、Cu2+;阴离子分别是NO3-、SO42-、Cl-、SO32-(离子不能重复出现)。做如下实验:
①分别溶于水,只有C溶液呈蓝色
②若把溶于水的四种溶液分别加入盐酸,B溶液出现沉淀,D溶液中有刺激性气体放出则A为溶液,B为溶液,C为溶液,D为溶液
(每空3分共计10分)硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式: 。
(2)上述流程中两次使用试剂①,推测试剂①应该是 (填以下字母编号)
| A.氢氧化钠 | B.氧化铝 | C.氨水 | D.水 |
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是 ;(任写一点)
(4)H中溶质的化学式: ;
(5)计算溶液F中c(Mg2+)= (25℃时,氢氧化镁的Ksp=5.6×10-12)
对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理的一种方法
①碱洗的目的是洗去铝材表面的自然氧化膜,碱洗时常有气泡冒出,其原因是(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的。
a.NH3b.CO2 c. NaOHd.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为。电解后的铝材需氨洗的目的是。阳极氧化膜中有微孔,需进行封孔,封孔的操作方法是。
2.镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是。
3.利用下图装置,可以模拟铁的电化学防护。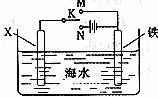
若X为碳棒,为减缓铁的腐蚀,开关K应该置于处。
若X为锌,开关K置于M处,该电化学防护法称为。
(8分)在一定条件下可实现下图所示物质之间的变化: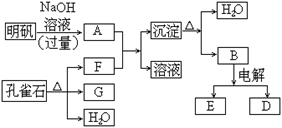
请填写以下空白:
(1)孔雀石的主要成分是Cu2(OH)2CO3,受热易分解。上图中的F的电子式为。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式。
(3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式。
(4)D与NaOH溶液反应的离子方程式为。
(8分)A、B、C、D为四种可溶性的盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-的中的一种。
①若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。根据①②实验事实可推断它们的化学式为:
⑴A,C
⑵写出盐酸与D反应的离子反应方程式:
⑶写出C与Ba(OH)2溶液反应的离子方程式