氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-.
试写出:
(1)(CN)2与KOH(aq)反应的化学方程式:____________________________;
(2)NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:_____________.
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤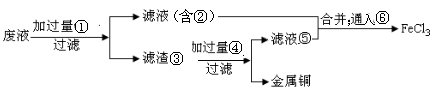
(1)请写出上述实验中加入或生成的有关物质的化学式
① ② ③ ④ ⑥
(2)写出FeCl3溶液与金属铜发生反应的化学方程式
(3)检验腐蚀废液中含有Fe3+的实验操作是
(4)废液加入过量①后,可能发生的离子方程式
化合物A、D、F是中学化学中最常见的物质,化合物B、C、E中含有两种相同的元素,这些化合物之间存在如下关系。其中A和B的反应是一种重要化工生产中的主要反应。
据此推断:
(1)在A、C、F中含有的相同元素是 。
(2)化合物C的化学式为 。
(3)A和B反应的化学方程式为 ,
该反应是在 中进行的(填设备名称)。
(4)C的水溶液和D能否发生反应? 。其理由是 。
若能够反应,则该反应的离子方程式为 (若不能,则此空不填)。
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)
(1)硝酸在该反应中表现出的性质是_____,该反应的还原产物是_____。
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是_____,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是_____mol。
(3)0.3molCu被另一浓度的硝酸完全溶解后,如果此时产生的NO和NO2气体总体积在标准状况下为8.96 L,则被还原的硝酸的物质的量是_____mol,参加反应的硝酸的物质的量是_____mol,产生的混合气体中NO和NO2体积比为_______。
用于分离或提纯物质的方法有:
| A.蒸馏(分馏) |
| B.萃取 |
| C.过滤 |
| D.重结晶 |
E.分液。
下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号.)
(1)除去Ca(OH)2溶液中悬浮的CaCO3微粒()
(2)分离四氯化碳与水的混合物()
(3)分离汽油和煤油()
(4)分离碘水中的碘单质()
(5)提纯氯化钠和硝酸钾混合物中的硝酸钾()
将0.1 mol的镁和铝的混合物溶于50 mL 4 mol·L-1H2SO4溶液中,然后再滴加2 mol·L-1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=80 mL时,计算金属粉末中镁的物质的量及V2的体积。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,计算滴入NaOH溶液的体积。