铁路提速为鲜活水产品、新鲜水果和蔬菜的运输提供了有利条件。
在鲜活鱼的长途运输中,必须考虑以下几点:水中需要保持适量的O2;及时除去鱼排出的CO2;防止细菌的大量繁殖。现有两种在水中能起供氧灭菌作用的物质,其性能如下:
过氧化钠(Na2O2):易溶于水,与水反应生成NaOH和O2;
过氧化钙(CaO2):微溶于水,与水反应生成Ca(OH)2(微溶)和O2。
根据以上介绍,你认为运输鲜活水产品时应选择 加入水中。原因是 。
在不通风场所,苹果会散发 的气味,时间久了会腐烂;马铃薯块茎通过
呼吸产生乳酸。铁路提速可减少鲜果和蔬菜在运输中的损耗。
对于下列氧化还原反应,请按要求填空。
(1)Cu + 4HNO3(浓)=== Cu(NO3)2 + 2NO2↑ + 2H2O
①氧化剂____________②离子方程式____________________________
(2)2H2S + SO2 === 3S↓ + 2H2O
①用双线桥法标出电子转移的方向和数目____________________________
②若氧化产物比还原产物多1.6g,则反应中电子转移的个数为________________
50 mL密度为1.84 g·cm-3,质量分数为98%的浓H2SO4,其H2SO4的物质的量浓度为。若将50 mL该浓H2SO4稀释成密度为1.47 g·cm-3的溶液100mL,需水mL。(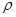 水=1g·cm-1)稀释后溶液的质量分数为,物质的量浓度为。
水=1g·cm-1)稀释后溶液的质量分数为,物质的量浓度为。
1.5molH2SO4的质量是_____________,其中含有__________mol H。
现有如下两个反应:
A、NaOH + HCl =" NaCl" + H2O
B、2FeCl3+Cu =2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池:A、, B、__________(选择“能”或“不能”);
(2)如果不能,说明其原因
________________________________________________________________;
(3)如果可以,则写出正、负极材料、电极反应式及电解质溶液名称:
负极材料________,电极反应式为,正极材料,电极反应式为,
电解质溶液名称是。
向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应:
xA(g)+ yB(g) pC(g) + qD(g)。已知:平均反应速率V(C)=1/2V(A);反应2min时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有amolD生成。回答下列问题:
pC(g) + qD(g)。已知:平均反应速率V(C)=1/2V(A);反应2min时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有amolD生成。回答下列问题:
(1)反应2min内,A的平均反应速率是mol•L-1•min-1;
(2)原化学方程式中,化学计量数是:
A(g)+ B(g)  C(g) + D(g)
C(g) + D(g)
(3)反应平衡时,D为2amol,则B的转化率为;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5amol,则该反应
的△H0;(填“>”、“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:
①反应速率增大,理由是体积减小,反应物的浓度增大,因而使反应速率增大;
②平衡时反应物的转化率(填“增大”、“减小”或“不变”),理由是