(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是
| A.电解水 | B.锌和稀硫酸反应 |
| C.光解海水 | D.以石油、天然气为原料 |
(2)氢气燃烧时耗氧量小,发热量大。已知,热化学方程式为:
C(g)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+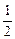 O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是___________。
(3)氢能源有可能实现能源的贮存,也有可能实现经济、高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g/cm3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式___________。
在某温度时,一定量的元素A的氢化物AH3在一定体积密闭容器中可完全分解成两种气态单质,此时压强增加了75% ,则A单质的一个分子中有______个A原子,AH3分解反应的化学方程式为___________
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)下列操作中,容量瓶具备的功能有__。
| A.配制一定体积准确浓度的标准溶液 |
| B.贮存溶液 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.用来加热溶解固体溶质 |
(2)根据计算用托盘天平称取NaOH的质量为_____g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1 mol/L(填“大于”、“等于”或“小于”,下同(。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度______0.1 mol/L。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为____mL(计算结果保留一位小数。
根据反应3Cu +8HNO3(稀(=3Cu(NO3(2 + 2NO↑+ 4H2O,回答下列问题:
(1)还原剂是_________,还原产物是_________。
(2)氧化剂与还原剂的物质的量之比是_________。
(3)用双线桥标上电子转移的方向和数目。
现有几种元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
失去一个电子后,形成Ne原子电子层结构 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
其单质之一是空气中主要成分,最常见的助燃剂 |
| Z |
形成双原子单质分子,黄绿色气体 |
(1)元素X的一种同位素用来作原子量标准,这种同位素的符号是 ;
(2)画出T的原子结构示意图 ;
(3)写出工业上制取单质Z的化学方程式 ;
(4)写出由T、Y和Z三种元素组成的一种化合物的化学式 ;写出该物质在水中的电离方程式
填空题
(1)写出图中仪器的名称:
① ② ③ ④
(2)物质①NaCl晶体 ②干冰 ③醋酸溶液 ④铜 ⑤BaSO4固体 ⑥蔗糖 ⑦无水酒精 ⑧熔融的KNO3 ⑨液氯 ⑩硫酸溶液
以上物质属于非电解质的是_______(填序号(。