下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
| 物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
| 能量/kJ |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
根据上述数据回答(1)~(5)题。
(1)下列物质本身具有的能量最低的是 。
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是 。
A.HCl B.HBr C.HI
(3)X2+H2 2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: 。
2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: 。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 。
(5)若无上表中的数据,你能正确回答出问题(4)吗?
答: ,你的根据是 。
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 |
强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示:
①反应I的化学方程式为。
②反应Ⅱ的离子方程式为。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH=时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2(填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠(填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为。
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;②2BrO3- +I2 = 2IO3-+ Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为,还原产物是。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。
先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为。
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1mol•L-1 100 mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为;该溶液pH<7的原因是(结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子。Na2SO3溶液放置于空气中一段时间后,溶液的pH(填“增大”“减小”或“不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。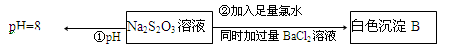
实验①可说明(填字母)
| A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L |
| B.H2S2O3是一种弱酸 |
| C.Na2S2O3是一种弱电解质 |
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH— H2S2O3+2OH— |
写出实验②发生反应的离子方程式。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答:
①此滴定实验是否需要指示剂(填“是”或“否”),KMnO4溶液置于(填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果会(填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=。Fe(CO)x常温下呈液态,熔点为 -20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于(填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子最近的所有阳离子为顶点构成的几何体为。已知该晶胞的密度为ρg/cm3,阿伏加德罗常数为NA,求晶胞边长a=cm。(用含ρ、NA的计算式表示)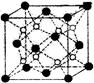
(3)原子序数小于36的X、Y、Z、M、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,M基态原子中s电子数等于p电子数。W的原子序数为29。回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为,空间构型。
②基态W原子的核外电子排布式。
③Y、Z、M三种元素的第一电离能由大到小的顺序为(用元素符号表示)化合物ZX3的沸点比化合物YX4的高,其主要原因是。
④元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是。
⑤YM、ZM混合气体污染的处理方法之一是将其在催化剂作用下转化为Z的单质。
已知::①YM(g)+ 1/2M2(g)=YM2(g)△H=-283.0kJ·mol-1
②Z2(g)+ M2(g)=2ZM(g)△H=+180.5kJ·mol-1
则上述反应的热化学方程式是。
铝是第二金属,是地壳中含量最多的金属,用途广泛。
51.将某铝土精矿R(Al2O3、Fe2O3)粉末48.8g加入含1mol NaOH的溶液中,发生的反应为:
Al2O3(s)+2NaOH(aq)+ 2H2O(l)→2NaAl(OH)4(aq)
充分反应后,过滤、洗涤、干燥,得到8.0g固体,则该精矿Al2O3的质量分数为(精确到0.001)。
往滤液中通入CO2,发生的反应为:2NaAl(OH)4 + CO2→2Al(OH)3↓+Na2CO3+ H2O
若生成0.5 mol Na2CO3,则生成Al(OH)3mol。
52.有反应Al2O3(s)+ Na2CO3(s)
 2NaAlO2(s)+ CO2(g)
2NaAlO2(s)+ CO2(g)
2NaAlO2(aq)+ CO2(g) +3H2O→2Al(OH)3↓+Na2CO3
若以铝土精矿R和Na2CO3为原料,除得到Al2O3外,还得到“赤泥”,其成分为(金属元素均以氧化物形式表示):
| Al2O3 |
Fe2O3 |
Na2O |
|
| 质量分数 |
0.065 |
0.850 |
0.029 |
每1t铝土精矿生产时:
得到的赤泥t(精确到0.001,下同);
可制得Al2O3得t;
需要补充购买Na2CO3kg。
53.取a g Al2O3加入溶质的质量分数为b的硫酸溶液中,充分反应后再往溶液加入一定量的(NH4)2SO4,加热、搅拌,冷却后全部溶液正好转化为45.3 g铝铵矾晶体[NH4Al(SO4)2·12H2O,式量:453],则a=;b=(精确到0.001).