.对可逆反应来说,使用催化剂的作用是( )
| A.提高反应物的平衡转化率 |
| B.以同样程度改变正逆反应的速度 |
| C.增大正反应速度,减小逆反应速度 |
| D.改变平衡混合物的组成 |
t℃时,某NaOH稀溶液中,c(H+ )=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=13, 则在该温度下,将100 mL0.10 mol·L-1的稀硫酸与100 mL0.40 mol·L-1的NaOH溶液混合后,溶液的pH为( )(已知:忽略溶液混合时体积的变化;lg2=0.30;lg3=0.48)
| A.12.00 | B.11.82 | C.11.70 | D.11.52 |
(原创)液氨与纯水类似,也存在微弱的电离:NH3+ NH3 NH4+ +NH2- ,下列说法不正确的是( )
NH4+ +NH2- ,下列说法不正确的是( )
| A.只要不加入其他物质,液氨中c(NH4+ )总是等于c(NH2-) |
| B.一定温度下, c(NH4+ )×c(NH2-)为常数 |
| C.其他条件不变,增加液氨的量,电离平衡正向移动 |
| D.维持温度不变,向液氨中加入少量NH4Cl固体,c(NH2-)将减少 |
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,发生反应:A(g)+B(g)  C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )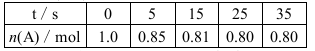
A.反应在前5 s的平均速率v(A)=0.03 mol·L-1·s-1
B.达到平衡时,B的转化率为80%
C.相同温度下,若起始时向容器中充入2.0 mol C,则达到平衡时C的浓度小于0.2 mol·L-1
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
用0.1000 mol·L-1NaOH溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是( )
| A.盛装待测液的锥形瓶用蒸馏水洗过,没用待测液润洗 |
| B.酸式滴定管在使用前未用待测液盐酸润洗 |
| C.滴定前碱式滴定管尖嘴中有气泡,滴定后气泡消失 |
| D.滴定前读数平视,滴定终点读数时俯视碱式滴定管的刻度 |
常温下,向纯水中加入NaOH使溶液的pH为11,则由NaOH电离出的OH 离子浓度和水电离出的OH离子浓度之比为 ( )
| A.1:1 | B.108:1 | C.5×109:1 | D.1010:1 |