下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于ds区的元素是 (填编号)。
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是 ;
③和⑦形成的常见化合物的化学键类型是 。
(3)元素⑧的外围电子排布式为 ,该元素原子中未成对电子数为 。
(4)在周期表中位于对角线的元素的性质也有一定的相似性。试写出元素②的氢氧化物与NaOH溶液反应的化学方程式: .
(5)在1183 K以下,元素⑨形成如图1所示基本结构单元的晶体;1183 K以上,转变 为图2所示基本结构单元的晶体。

在1183 K以下的晶体中,与元素⑨的原子等距离且最近的原子数为 ;
在1183 K以上的晶体中,与元素⑨原子等距离且最近的原子数为 。
(B).
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:
奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。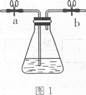

某校化学兴趣小组用图1装置进行下述实验:
①在250 mL锥形瓶中,依次加入2g NaOH、100mlH2O和2g葡萄糖,搅拌溶解后,再加入3~5滴0.2%的亚甲基蓝溶液,振荡混合液呈蓝色;
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③、④可重复多次。
请回答下列问题:
(1)若塞紧图1中锥形瓶塞,并打开导管活塞a、b,从导管口(填“左”或“右”)通入足量氦气后,再关闭活塞a、b并振荡,溶液 (填“能”或“不能”)由无色变为蓝色。
(2)如图2所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是 试管。
(3)上述转化过程中葡萄糖的作用是 ,亚甲基蓝的作用是
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为 。
(5)该实验中③、④操作 (填“能”或“不能”)无限次重复进行,理由是 。
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: +4H++3e-=NO+2H2O 。已知Cu2O能使上述还原过程发生。
+4H++3e-=NO+2H2O 。已知Cu2O能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式:______________。
(2)反应中硝酸体现了________、_________的性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是___________mol。
(4)若1 molCu2O与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是__________ _。
_。
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1) 合成氨工业中原料气压缩到30~50MPa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是。
。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是。
(2) 500℃、50MPa时,在容积为VL的容器中加入nmolN2、3nmolH2,反应达平衡后测得平衡常数为K1,此时N2的转化率为x。则K1和x的关系满足K1=。若温度为400℃,平衡常数为K2,则K1K2(填“<”、“=”或“>” )
(3) 甲烷在高温下与水蒸气反应的热化学反应方程式为:
CH4(g)+H2O(g)=CO(g)+3H2(g); △H kJ·mol-1。
又已知: H2(g) +1/2 O2(g)="=" H2O(l);△H1=-285.8kJ/mol
CO(g) + 1/2 O2(g)=CO2(g) ;△H2=-283.0kJ/mol
CH4(g) +2 O2(g)="=" CO2(g) + 2H2O(l); △H3=-890.3kJ/mol
H2O(g) ="=" H2O(l); △H4=-44.0kJ/mol
①写出H2(g)完全燃烧生成气态水的热化学方程式。
② CH4(g)+H2O(g)=CO(g)+3H2(g); △H=kJ/mol
淡黄色固体A和气体X存在如下转化关系:
请回答下列问题
(1)固体A的名称,X的化学式。
(2)反应③的化学方程式为。
(3)写出反应②④的离子方程式:
反应②。
反应④。
(4)溶液 C中的阴离子主要是_
C中的阴离子主要是_ _________,检验该离子的实验操作为______________
_________,检验该离子的实验操作为______________
_________________________________。
化学计量在化学中占有重要地位,请回答下列问题:
(1)现有mg某气体,它由双原子分子构成,其摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
①该气体的物质的量为___ _____;
_____;
②该气体所含原子总数为个;
③该气体在标准状况下的体积为__________。
(2)与标准状况下V LCO2所含氧原子数目相同的水的质量是_______(用分式表示)。
(3)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是______________。
(4)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、SO42 -,测得Na+、Mg2
-,测得Na+、Mg2 +和Cl-
+和Cl-
的物质的量浓度依次为:0.2 mol·L-1、0.25 mol·L-1、0.4 mol·L-1,则c(SO42-)="___________" 。
现有以下5种物质:H2O、SiO2、CaO、Na2O2、Al2O3。
(1)按照不同的分类标准,它们中有一种物质与其它物质有明显的不同,请找出这种物质并写出依据(试写出任意一种合理的分类方法):
。
(2)上述物质中有些可以两两反应,试写出一个属于氧化还原反应的离子反应方程式__________ ______________________________________________________________。
______________________________________________________________。