小刚同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验。
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为 ,过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为 。
(2)请回答有关问题。小刚同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:
则操作①的名称为 ,试剂A的化学式为 。
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是______(填化学式),则产生该白色沉淀的离子方程式是__ _ ___。
研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2+H2O,制备SO2气体。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
② 实验过程中,使用分液漏斗滴加浓硫酸的操作是。
(2)将SO2气体分别通入下列溶液中:
① 品红溶液,现象是;
② 溴水溶液,现象是;
③ 硫化钠溶液,现象是。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
① 原因,验证方法。
② 原因,验证方法。
③ 原因,验证方法。
标准状况下,将1L可能含有N2,H2,CO,NH3,NO2,H2S杂质的无色SO2气体,依次通过如下图所示的装置。(各容器中液体均为足量)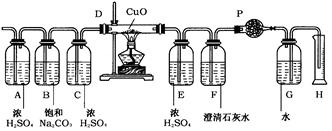
其变化情况是:①气体通过A瓶,浓H2SO4无明显变化,气体体积无变化;②气体通过B瓶,饱和Na2CO3溶液质量增加0.5g,气体体积无变化;③气体通过C瓶后,再通过D管,灼热的CuO中有红色物质生成。冷却后,气体体积变为888ml(标准状况);④将上述气体通过E后,再通入F中,澄清石灰水变浑浊,同时增重1.54g;⑤气体经过干燥管P后,在量筒H中,收集到水104ml。根据以上实验回答:
(1)混合气体中SO2的体积分数为______________。
(2)混合气体中含有的杂质为______________。
(3)混合气体中是否含有H2、CO杂质;若有,指出其体积;若无,说明理由。
a.H2:____________________________________________________________________;
b.CO: ____________________________________________________________________。
A~H等8种物质存在如下转化关系(反应条件,部分产物未标出)。已知:A是正盐, B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题:
(1)写出下列物质的化学式:A,B,C。
(2)写出下列反应的化学方程式:
E→F;
G→H;
D的浓溶液与木炭反应的方程式:。
(3)检验某溶液中是否含D中阴离子的方法是。
某课外小组利用下图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是___________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液,加热时溶液由无色变为红色的原因是_______________________。
常温下,将Fe粉和S粉混合,不发生反应.某课外活动小组将Fe粉和S粉按物质的量比1∶1混合均匀,并置于水平放置且隔绝空气的玻璃管中,加热片刻,反应开始,然后撤去酒精灯,发现反应仍能剧烈进行,并使生成的固体呈红热状态.试回答:
(1)上述现象说明了_______________________.
(2)将生成的黑色固体置于稀H2SO4中,有气体放出,写出发生反应的离子方程式______.
(3)已知H2S是一种剧毒、有刺激性气味的气体,试说明实验室制取H2S时应采用的一条安全措施:___________________.