在21℃和充分搅拌下,将不同体积1.0 mol·L—1 HCl溶液和未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下:
| 盐酸的体积V(mL) |
5.0 |
10.0 |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
40.0 |
45.0 |
| NaOH的体积(mL) |
45.0 |
40.0 |
35.0 |
30.0 |
25.0 |
20.0 |
15.0 |
10.0 |
5.0 |
| 溶液温度t(℃) |
22.2 |
23.3 |
24.6 |
25.8 |
27.0 |
27.8 |
26.1 |
24.4 |
22.8 |
(1)在给定的坐标图上绘出溶液温度与盐酸体积的关系图。
(2)假定酸碱恰好完全反应前后,溶液温度与盐酸体积可以近似
地认为呈线性关系。请写出溶液温度t与盐酸体积V的线性
关系式(请用含有t和V的式子表示) 、 。
(3)所用NaOH溶液的物质的量浓度= 。
备用 . 四氧化三铅俗名“铅丹”或“红丹”,由于有氧化性被大量地用于油漆船舶和桥梁钢架防锈,其化学式可写为2PbO·PbO2。欲测定某样品中四氧化三铅含量,进行如下操作:
①称取样品0.1000g,加酸溶解,得到含Pb2+的溶液。
②在加热条件下用过量K2Cr2O7将Pb2+沉淀为PbCrO4,冷却后过滤洗涤沉淀。
③将PbCrO4沉淀用酸溶液溶解(沉淀溶解的离子方程式为:2PbCrO4+2H+=
2Pb2+Cr2O72-+H2O),加入过量KI,再用0.1000mol·L―1 Na2S2O3溶液滴定,到滴定终点时用
去12.00mL(滴定过程中离子方程式为:I2+2S2O32-=2I-+S4O62-)。
则:(1)写出步骤③中加入过量KI后溶液中发生的离子反应方程式 。
(2)用标准溶液滴定时所用的指示剂是 。(写试剂名称)
(3)计算试样中Pb3O4的质量分数。(Pb的相对原子质量为207.2)
自2010年8月7日,甘肃省舟曲县发生特大泥石流后,各地的救援物资远远不断运往灾区。下图为地方捐助的一种国家准字号补铁补血用药——复方硫酸亚铁叶酸片,其主要成分是绿矾——硫酸亚铁晶体(FeSO4·7H2O)。
Ⅰ、某校课外活动小组为测定该补血剂中铁元素的含量特设计实验步骤如下: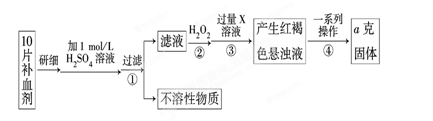
请回答下列问题:
(1)步骤②中加入过量H2O2的目的是。
(2)步骤③中反应的离子方程式为。
(3)步骤④中一系列处理的操作步骤是:过滤、、灼烧、、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为g(用含a的代数式表示)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO+8H+===5Fe3++Mn2++4H2O)。
某同学设计的下列滴定方式中,最合理的是(夹持部分略去)(填字母序号)。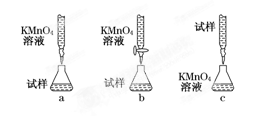
Ⅱ、灾难过后,灾区的饮用水变得非常的浑浊,不能饮用。因此对污染的饮用水的处理成了非常重要的事,其中处理的方法有很多:
(1)可以用适量绿矾和氯气一起作用于污染的自来水,而起到较好的净水效果;理由是(用离子方程式表示)。
(2)在使用过程中发现绿矾和氯气的混合使用对酸性废水中的悬浮物处理效果较差,其原因是。
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。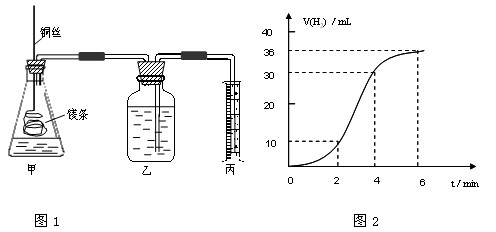
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请根据实验中现象并结合图2中数据回答0到6分钟内哪一段速率最快。
A: 0—2 分钟 B: 2—4 分钟 C: 4—6分钟
②并请简述速率出现这种情况的其原因:
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO2- 4对反应没有影响;
原因Ⅱ:Cl-对反应没有影响,而SO2- 4对反应具有阻碍作用;
原因Ⅲ:____________________________________________________;
原因Ⅳ:Cl-、SO2- 4均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:________________________________________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中________________________,实验b中________________________,则说明原因Ⅰ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③溶解 ④转移、洗涤 ⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是________________________________。
(3)第⑤步实验的操作是________________________________。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中_________
B.容量瓶用蒸馏洗涤后残留有少量的水________________
C.所用过的烧杯、玻璃棒未洗涤________________
D.量取浓硫酸的量筒用蒸馏水洗涤后倒入烧杯__________
E.量取浓硫酸时俯视读数
F.定容时俯视刻度线________________
某学生用已知质量y g的表面皿,准确称取w g NaOH固体。他在托盘天平的右盘上放(w+y)g砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边(如图所示):
(1)下面他的操作应该是______________________,使_________________。
(2)若称取的w g NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制500mLNaOH溶液过程示意图中有错误的是(填操作序号)
18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫酸100 ml,实验操作如下:
(1)计算并用量筒量取ml的18.0 mol·L-1的浓硫酸;
(2)将沿烧杯内壁慢慢注入盛有少量的烧杯中;
(3)将已冷却至室温的硫酸溶液沿玻璃棒注入___________;
(4)用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
(5)继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处,改用胶头滴管逐滴加蒸馏水,至液面与刻度线相切
(6)盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签保存。
试分析下列操作对实验结果的影响(偏高、偏低或无影响)
①没有洗涤烧杯和玻璃棒
②定容时俯视读数
③容量瓶使用前有少许水残留