影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。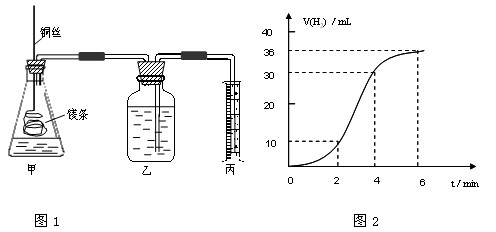
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请根据实验中现象并结合图2中数据回答0到6分钟内哪一段速率最快 。
A: 0—2 分钟 B: 2—4 分钟 C: 4—6分钟
②并请简述速率出现这种情况的其原因:
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO2- 4对反应没有影响;
原因Ⅱ:Cl-对反应没有影响,而SO2- 4对反应具有阻碍作用;
原因Ⅲ:____________________________________________________;
原因Ⅳ:Cl-、SO2- 4均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:________________________________________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中________________________,实验b中________________________,则说明原因Ⅰ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂。请填写下列空白:
(1)碱式滴定管的使用方法,正确步骤的先后顺序为(填选项符号):
A.用氢氧化钠溶液润洗仪器并加入氢氧化钠溶液
B.放出氢氧化钠溶液进行滴定
C.调节起始读数
D.查漏,再水洗2-3遍
(2)用标准的NaOH溶液滴定待测的盐酸时,左手控制碱式滴定管的玻璃球,右手摇动锥形瓶,眼睛应注视;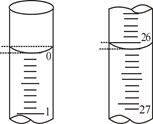
(3)若滴定开始和结束时,碱式滴定管中的液面如上图所示:则所用NaOH溶液的体积为mL。
(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 |
待测盐酸的体积/mL |
0.1000 mol/LNaOH溶液的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
2.00 |
28.15 |
26.15 |
| 第二次 |
25.00 |
1.50 |
29.50 |
28.00 |
| 第三次 |
25.00 |
0.20 |
26.55 |
26.35 |
请选用其中合理的数据计算该洗厕精中酸(盐酸)的物质的量浓度:
c(HCl)=。
(5)分析下列操作对所测洗厕精的酸(盐酸)的浓度的影响:(填“偏大”、“偏小” 或“无影响”)
A.若取待测液时,开始仰视读数, 后俯视读数,则;
B.若碱式滴定管在滴定前有气泡,滴定后气泡消失,则。
TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,与氢气的相对分子质量之比为120。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。其主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。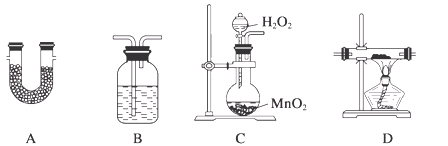
(1)将所选用的仪器(可重复选用)连接顺序由上到下依次填入下表,并写出该仪器中应加入的试剂的名称及作用。
| 选用的仪器 |
加入试剂 |
加入试剂的作用 |
| C |
H2O2溶液与MnO2 |
产生氧气 |
| D |
CuO粉末 |
将可能生成的CO转化为CO2 |
(2)实验后称得A及以后的装置(均用A装置并假设每次吸收均是完全的)质量依次增加3.60 g、14.08 g、0.14 g,则TMB的分子式为__________________________。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下: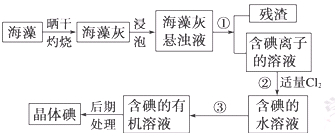
(1)指出操作③的名称:;操作②中充入适量Cl2的目的是。
(2)提取碘的过程中,可供选择的试剂是 ( )
| A.酒精 | B.四氯化碳 | C.汽油 | D.醋酸 |
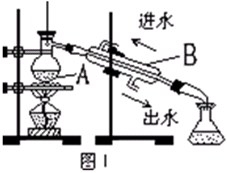
(3)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏。图I是某同学设计的蒸馏装置,图中明显的错误是。
(4)有同学认为蒸馏时最好使用水浴加热,使用水浴的优点是:;蒸馏结束,晶体碘聚集在(填仪器名称)里。
(5) 实验③分离出来的废液中含有Cl–、SO42–,现只取一次试液,如何鉴别出Cl–、SO42–,依次加入试剂的为:、。
(6)某小组同学实验时需用到一定物质的量浓度的碘水溶液225mL,配制时需要的仪器除天平、玻璃棒、烧杯外,还需、。若摇匀时,发现液面低于刻度线,则配得溶液浓度(填偏大、偏小或无影响)。
实验室用乙醇和浓硫酸共热制取乙烯,常因温度过高而生成少量的二氧化硫,有人设计下列实验以确认上述混和气体中有乙烯和二氧化硫。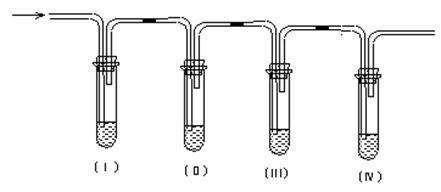
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:I;II;III;IV(将下列有关试剂的序号填入空格内);
| A.品红溶液 | B.氢氧化钠溶液 | C.浓硫酸 | D.酸性高锰酸钾溶液 |
(2)能说明二氧化硫气体存在的现象是 ______________________________________;
(3)使用装置Ⅱ的目的是 _________________________________________________ ;
(4)使用装置Ⅲ的目的是___________________________________________________;
(5)确证含有乙烯的现象是_________________________________________________。
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: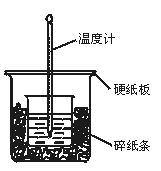
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”“不相等”),所求中和热(填“相等”“不相等”),简述理由:。