24.分离或提纯下列物质,应选用下述方法的哪一种?(填序号)
| A.分液 | B.过滤 | C.萃取 | D.蒸馏 E、结晶 F、加热分解 H、渗析 |
(1)除去Ca(OH)2溶液中悬浮的 CaCO3 ;(2)从碘水中提取碘 ;
(3)除去氢氧化铁胶体中少量氯化铁溶液 ;(4)分离植物油和水 ;
(5)除去 Na2CO3中少量的NaHCO3 (6)用自来水制取蒸馏水 ;
A装置中装有淡黄色的固体,分液漏斗中装有浓盐酸,B中盛浓硫酸,C中放有催化剂,D中盛淀粉碘化钾溶液,E中盛足量的NaOH溶液,F中盛FeSO4和H2SO4混合溶液。
先打开止水夹,通入N2,待装置中空气被赶尽后关诩止水夹,点燃酒精灯:从分液漏斗放入浓盐酸,D中溶液迅速变蓝,F中溶液由浅绿色变为棕黄色(整个装置乖O3)。
(1)淡黄色固体所含化学键的名称为:________;装有遮黄色的固体仪器的名称_______。
(2)如何检查装置的气密性___________________________________________________。
(3)C中反应的化学方程式___________________________________________________。
(4)E装置中反应的离子方程式_______________________________________________。
(5)如F中仍有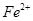 ,如何检验含有Fe2+____________________________________。
,如何检验含有Fe2+____________________________________。
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式。
(2)实验装置(如图所示)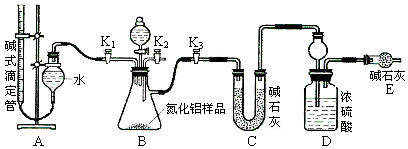
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL。
②称取xg AlN样品置于锥形瓶中;塞好胶塞,关闭活塞,打开活塞,通过分液漏斗加入稀硫酸,与烧瓶内物质充分反应。
③待反应进行完全后,关闭活塞,打开活塞,通过分液漏斗加入过量(填化学式),与烧瓶内物质充分反应。
④(填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析
①AlN的质量分数为。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积(填“偏大”、“偏小”或“无影响”)。
③Al4C3的质量分数为。(该实验条件下的气体摩尔体积为Vm)。
过碳酸钠和盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O,商品过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,取一定量的样品和盐酸反应,通过测量产生的氧气的体积,可以计算出过碳酸钠的含量。
(1)根据下图提供的仪器装置,组装一套测定商品过碳酸钠的实验装置,这些装置的连接顺序是(填接口字母):。
①②③④⑤
(2)装置④的作用是。
(3)如果实验时,称取w g样品和过量盐酸反应后,测得氧气的体积(标准状况)为V mL,则此样品的纯度为。
(1)实验室用二氧化锰跟浓盐酸反应制取氯气的离子方程式为。
(2)高锰酸钾是常用氧化剂,在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气的离子方程式为。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,反应的化学方程式为。
(4)现有100 mL AlCl3与MgSO4的混合溶液,分成两等份。
① 向其中一份中加入10 mL 4 mol/L的氨水,恰好完全沉淀,其中AlCl3与氨水反应的离子方程式是。继续加入1 mol/L NaOH溶液至10 mL时,沉淀不再减少,沉淀减少的离子方程式是,减少的沉淀的物质的量是。
② 向另一份中加入a mL 1 mol/LBaCl2溶液能使SO42-沉淀完全,a=。
向溴水中加入足量乙醛溶液,可以看到溴水褪色。据此对溴水与乙醛发生的有机反应类型进行如下探究,请你完成下列填空:
I.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醛发生加成反应;
(3)溴水与乙醛发生_______反应。
II.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案l:检验褪色后溶液的酸碱性。
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量。
(1)方案1是否可行?_______,理由是__________________________________________
(2)假设测得反应前用于溴水制备的Br2的物质的量为a mol 。
若测得反应后n(Br-) = _______mol,则说明溴水与乙醛发生加成反应;;
若测得反应后n(Br-) = _______mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-) = _______mol,则说明猜测(3)正确。
III.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙醛溶液使其褪色;再加入过量AgNO3溶液,得到淡黄色沉淀l.88 g(已知反应生成有机物与AgNO3不反应)。根据计算结果,推知溴水与乙醛反应的离子方程式为__________________________________________。
IV.拓展
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表)。
| 实验操作步骤 |
实验现象 |
结论 |