实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500g。
步骤Ⅱ 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点的判断是 。
(2)滴定结果如下表所示: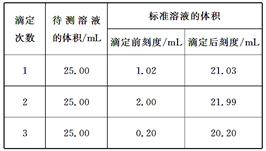
若NaOH标准溶液的浓度为0.1010mol/L,则该样品中氮的质量分数为 。
某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出):
请回答下列问题:
(1)加热过程中,观察到A容器中出现大量白色烟雾,随着反应的进行,底部有白色沉淀生成,该沉淀物是________。
(2)对A容器中的浓H2SO4和铜片进行加热,很快发现C容器中品红溶液褪色,但始终未见D容器中澄清石灰水出现浑浊或沉淀。你的猜想是_______。设计实验验证你的猜想_____________。
铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同.
(1)某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置,请你根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤:
药品:稀硝酸 稀盐酸 锌粒 石灰石固体
步骤:①检查装置的气密性②;③;④ ;⑤;⑥用注射器向试管内推入氧气(或空气)
(2)推入氧气或空气的目的是;
(3)分别将等质量的铜片与等体积均过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出,这可能是Cu2+的浓度差异引起的,你同意这种看法吗?
(填同意或不同意),原因是
另一位同学提出溶液呈绿色是Cu2+与NO2混合的结果,请你设计一个实验证明之(简述实验方案和实验现象)。
某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。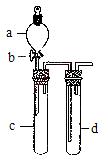
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的化学方程式是。再由a向c中加2 mL蒸馏水,c中的实验现象是 。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是。理由是_____________。
| 方案 |
反应物 |
| 甲 |
Cu、浓HNO3 |
| 乙 |
Cu、稀HNO3 |
| 丙 |
Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2。操作步骤为,实验现象 ;但此实验的不足之处是 。
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:
_____________________________________________________________
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。这些装置的连接顺序是(按产物气流从左至右的方向,填写装置的编号):____→____→____→____。
(3)实验时可观察到装置①中A瓶的溶液褪色。A瓶溶液的作用是_________,
B瓶溶液的作用是_______,可用_______代替,C瓶溶液的作用是________________。
(4)装置②中所加的固体药品是____________,可验证的产物是____________,确定装置②在整套装置中位置的理由是______________。
(5)装置③中所盛溶液是_____________,可验证的产物是__________。
(6)如果按照①②③的顺序连接,可以检出的物质是_________,不能检出的是_________;
如果按照②③①的顺序连接,可以检出的物质是_________,不能检出的是_________;
如果按照①③②的顺序连接,可以检出的物质是_________,不能检出的是_________;
有一无色溶液,可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示: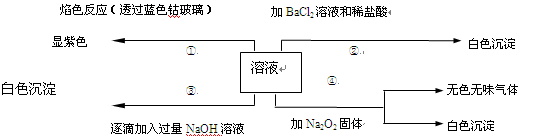
在第③个实验中,生成白色沉淀的量与加入NaOH的量有
图所示的相互关系。据此可知:
⑴在原溶液中一定不存在的离子有_____________________。
⑵为满足该溶液中一定存在的离子的要求,一般可溶解两
种常见物质为(写化学式)___________和_________。
⑶写出第③个实验中发生反应的离子方程式
_______________________ ___ ______
。