氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s) + H2O(g)  H2(g) + CO(g) △H =" +131.3" kJ ,△S =" +133.7" J/K
H2(g) + CO(g) △H =" +131.3" kJ ,△S =" +133.7" J/K
该反应在低温下能否自发 (填:能或否)。
(2)已知在400℃时,N2 (g)+ 3H2(g) 2NH3(g)的K=0.5,
2NH3(g)的K=0.5,
①2NH3(g) N2 (g)+ 3H2(g)的K= (填数值)。
N2 (g)+ 3H2(g)的K= (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)
(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
| A.图Ⅰ可能是不同压强对反应的影响,且P2>P1 |
| B.图Ⅱ可能是不同压强对反应的影响,且P1>P2 |
| C.图Ⅲ可能是不同温度对反应的影响,且T1>T2 |
| D.图Ⅱ可能是同温同压下,催化剂性能,1>2 |

某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)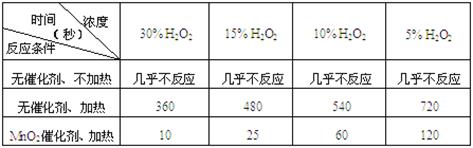
①该小组在设计方案时,考虑了浓度、a:、b:等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
| 催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
混合不振荡 |
剧烈反应,带火星的木条复燃 |
3.5分钟 |
| 块状 |
反应较慢,火星红亮但木条未复燃 |
30分钟 |
①写出H2O2发生的化学反应方程式 _____________________。
②实验结果说明催化剂作用的大小与_________________有关。
(11分)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。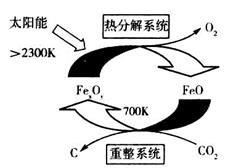
①若“重整系统”发生的反应中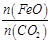 =6,则FexOy的化学式为______________。
=6,则FexOy的化学式为______________。
②“热分解系统”中每分解l mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)=2CH3OH △H2=+23.4kJ·mol-1
则2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H3=kJ·mol-1
CH3OCH3(g)+3H2O(g) △H3=kJ·mol-1
①一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中的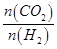 值变小
值变小
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如下图所示。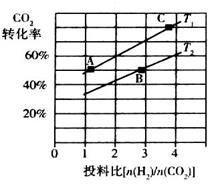
T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率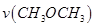 =______;KA、KB、KC三者之间的大小关系为______________。
=______;KA、KB、KC三者之间的大小关系为______________。
Ⅰ.图甲是一定的温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示):。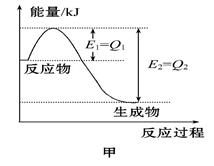
Ⅱ.(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应,
已知:N2(g)+3H2(g)="=" 2NH3(g) ΔH="-92.4" kJ·mol-1,
2H2(g)+O2(g)====2H2O(l) ΔH="-571.6" kJ·mol-1,
则2N2(g)+6H2O(l)="=" 4NH3(g)+3O2(g) ΔH=;
(2)饮用水中的NO3-主要来自于NH4+。已知在微生物的作用下, NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如图乙: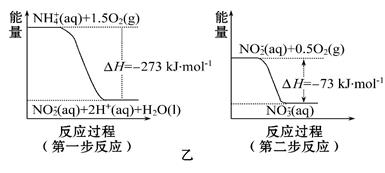
1 mol NH4+全部被氧化成NO3-的热化学方程式为。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零。D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为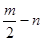 。请回答下列问题:
。请回答下列问题:
(1)D元素在周期表中的位置是_____________________;
(2)写出一个E和D形成的化合物与水反应的离子方程式_______________________;
(3)已知:甲+ H2O → 丙+ 丁。若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,丙具有漂白性。则甲中Cl元素的化合价是,丁与H2O有相同的电子总数,则丁的化学式为。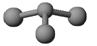
(4)与D同主族上下相邻的元素M、N,原子电子层数M>N>D,三种元素氢化物沸点由大到小的顺序是(填写化学式)。
(5)写出B与D在高温下完全反应后生成物的电子式___ __,结构式___
【化学——选修3:物质结构与性质】A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素。A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题:
(1)D的基态原子价层电子排布式为__________ 。
(2)C的氢化物的沸点比其上一周期同族元素的氢化物低,是因为__________。
(3)A、C电负性大小顺序是_______(用元素符号表示),C的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为___________。
(4)A、B形成的化合物的晶胞如图所示,该晶胞的化学式为_________,其中A离子的配位数为__________,该晶体类型为___________。
(5)该晶胞的边长为a pm(NA表示阿伏伽德罗常数),则该晶胞的密度为______g/cm3(列出算式)。