为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下: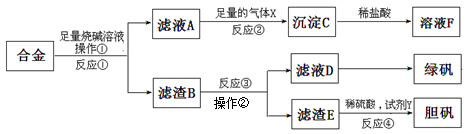
请回答:
(1)绿矾的化学式为 。
(2)写出反应①的化学方程式 ,反应②生成沉淀的离子反应方程式 。
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选): 。
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是 。
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为 ;若不考虑绿色化学工艺,所选试剂Y为1mol/L的硝酸,欲使3molCu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积 L。
硫酸的性质有:
| A.强酸性; | B.吸水性; | C.脱水性; | D.强氧化性。 |
在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空:
(1)实验室干燥氢气___________________;
(2)浓硫酸与金属铜的反应________________;
(3)实际生产中,浓硫酸可用钢瓶贮运_________;
(4)浓硫酸使蔗糖变黑,且有刺激性气味的气体产生_______________。
为了测定某有机物A的结构,做如下实验;
①将4.6 g该有机物完全燃烧,生成0.2mol CO2和5.4g水;
②用质谱仪测定其相对分子质量,得如下图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示谱图,图中三个峰的面积之比是1:2:3.
试回答下列问题:
(1)有机物A的相对分子质量是__________.
(2)有机物A的结构简式是__________.
(3) 写出有机物A的同分异构体的结构简式_______________.
(4) 写出由有机物A制备1,2-二氯乙烷过程的方程式
(1)有9种微粒:①NH2-;②—NH2;③Br-;④OH-;⑤—NO2;⑥—OH;⑦NO2;⑧CH3+;⑨—CH3.属于官能团的有(填序号)________ 。
(2)有下列8种晶体,用序号回答下列问题:
| A.水晶 |
| B.冰 |
| C.白磷 |
| D.固态氩 |
E.氯化铵
F.铝
G.金刚石
①属于原子晶体是,直接由原子构成的分子晶体是_____ 。
②由极性分子构成的分子晶体是,含有共价键的离子晶体是_____ 。
③在一定条件下能导电而不发生化学反应的是_____。
分子内存在化学键,但受热熔化时,化学键不发生变化的是_____。
(3)在NaCl晶胞中8个顶点 、6个面心处各有一个Na+ ,12条棱的中点、体心各有一个Cl- ,KCl和NaCl的晶格型式相同。已知Na+离子的半径是Cl-离子的0.5倍,是K+离子的0.7 倍,计算:KCl晶胞和NaCl晶胞的边长之比为_____ 。
(4)如下图:由正五边形构成的多面体有20个顶点,多面体中有_____个正五边形,共有____条棱边.
(14分)使用如图所示装置进行化学小实验,请填写下列空白:
(1)若①中放一片湿润的红色石蕊试纸,②装有浓氨水,可观察到的实验现象为。
(2)若①装有AlCl3溶液,②装有浓氨水,可观察到的实验现象为,反应的离子方程式为。
(3)若①装有浓硝酸,②装有浓氨水,可观察到的实验现象为,反应的化学方程式为。
(4)若①装有浓硝酸,②装有Na2SO3溶液,实验时有无色气体产生,该气体逐渐变为红棕色,用化学方程式表示无色气体变为红棕色的原因,写出浓硝酸和Na2SO3溶液反应的离子方程式 。
按要求回答下列问题:
(1)下列事实反映了硫酸、硝酸的什么性质:
①实验室用锌粒和稀硫酸反应制取氢气;
②浓硫酸能使胆矾晶体由蓝变白;
③浓硫酸使纸张变黑;
④硝酸溶解金属铜;
⑤可用稀硝酸与CaCO3作用制取CO2。
(2)将6.4g铜与一定浓度的浓硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为1.12L,请回答下列问题:
①写出铜与浓硝酸反应生成NO2气体的离子方程式:;
②参加反应的HNO3的物质的量是:mol。