有增长碳链是有机合成中非常重要的反应。例如:
反应①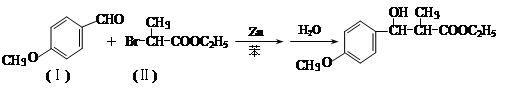
用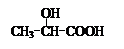 通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ):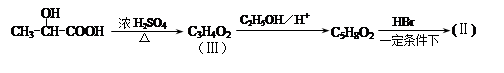
(1)(Ⅰ)的分子式为 ;1mol该物质完全燃烧需要消耗 mol O2.。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为 。
(Ⅲ)的结构简式为 ;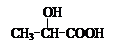 在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,该反应的反应类型是 。
在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,该反应的反应类型是 。
(4)对二氯苯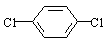 也能与有机物(Ⅰ) (过量)发生类似反应①的系列反应,其生成有机物的结构简式为 。
也能与有机物(Ⅰ) (过量)发生类似反应①的系列反应,其生成有机物的结构简式为 。
下图表示的是向Na2CO3溶液中滴入稀盐酸(单位为ml)时产生CO2的过程。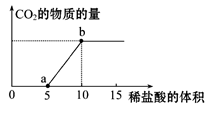
(1)写出a点以前发生反应的离子方程式:
(2)写出a到b点发生反应的离子方程式:
(3)若某Na2CO3溶液中含84.8g Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2∶1,则滴入的稀盐酸中的HCl的物质的量为mol(保留小数点后两位数字)。
(4)已知HCO3-+OH-=== CO32-+H2O ,若某溶液中含1 mol NaHCO3,滴入一定量的稀NaOH,恰好使溶液中Na+ 和HCO3-的物质的量之比为2:1,则滴入的NaOH的物质的量为mol。
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下
3Cu + 8HNO3 ="=" 3Cu(NO3)2 + 2NO↑+ 4H2O
(1)上述反应中氧化剂与氧化产物的物质的量之比。
(2)若生成NO的体积为3.36L(标准状况),且硝酸足量,则消耗铜的质量g,转移电子的数目为,被还原的硝酸为mol。
(3)写出该反应的离子方程式。
(10分)图示的四个容器中分别盛有不同的溶液,除A、B外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4 2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb。
2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb。
闭合S,发现G电极附近的溶液变红,20 min后,将S断开,此时C、D两极上产生的气体体积相同;据此回答:
(1)A电极的电极材料是______________(填“PbO2”或“Pb”)。
(2)电解后,要使丙中溶液恢复到原来的浓度,需加入的物质是________(填化学式)。
(3)到20 min时,电路中通过电子的物质的量为________。
(4)0~20 min,H电极上发生反应的电极反应式为______________
常温下有浓度均为0.5 mol·L-1的四种溶液:①Na2CO3、②NaHCO3、③HCl、④NH3·H2O。
(1)上述溶液中,可发生水解的是_______(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为__________。
(3)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”“减小”或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是 ________。
(5)以10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
现有常温下的五份溶液:
①0.01 mol·L-1 CH3COOH溶液; ②0.01 mol·L-1 HCl溶液;
③pH=12的氨水; ④pH=12的NaOH溶液;
⑤0.01 mol·L-1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是______(填序号,下同),水的电离程度相同的是______;
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②________③(填“>”、“<”或“=”);
(3)将前四份溶液同等稀释10倍后,溶液的pH:
①________②,③________④ (填“>”、“<”或“=”);