如下图所示的各物质的相互转变中,反应①、②是重要的工业反应,A的相对分子质量为120。X被人体吸入会与血红蛋白结合而使人中毒,Y会造成温室效应,D会形成酸雨,E是常见的金属,F分子的结构与Y分子的结构相似,且F的相对分子质量为60。 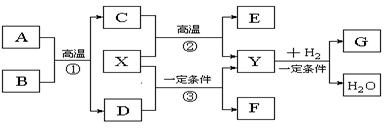
回答下列问题:
⑴反应①的化学方程式
为: 。
⑵反应②的化学方程式
为: 。
⑶写出F的结构式: 。
⑷Y与H2在一定条件下可生成多种物质,既可获得经济效益,也可减轻对环境的污染。
①若G是一种燃料,其相对分子质量与B的相对分子质量相等,则G的分子式为: 。
②若G是Y与H2按1∶3的比例反应而得,则G可能是 。(填编号)
| A.烷烃 | B.烯烃 | C.炔烃 | D.芳香烃 |
有平衡体系CO(g)+2H2(g) CH3OH(g),△H<0。为了增加甲醇的日产量,从理论上来讲应该采取的正确措施是()
CH3OH(g),△H<0。为了增加甲醇的日产量,从理论上来讲应该采取的正确措施是()
| A.高温、高压 | B.适宜的温度、高压、催化剂 |
| C.低温、高压 | D.高温、高压、催化剂 |
1molN2和3molH2混合发生反应N2+3H2 2NH3,达到平衡时,测得平衡混合物的密度是同温.同压下H2的5倍,则N2的转化率为()
2NH3,达到平衡时,测得平衡混合物的密度是同温.同压下H2的5倍,则N2的转化率为()
| A.75% | B.25% | C.30% | D.10% |
下列有关合成氨工业的说法中,正确的是()
| A.从合成塔出来的混合气体。其中氨气只占13%-14%,所以生产氨的工厂的效率都很低 |
| B.由于氨易液化,氮气、氢气是循环使用的,总体来讲氨的产率比较高 |
| C.合成氨反应温度控制在500℃左右,目的是使化学平衡向正方向移动 |
| D.合成氨采用的压强是2×107~5×107Pa,因为该压强下铁触媒的活性最大 |
合成氨所需要的氨气可由煤与水反应制得,其中有如下反应:CO(g)+H2O(g)=CO2(g)+H2(g),△H>0. 欲提高CO的转化率可采用的方法是()
①降低温度②增大压强③使用催化剂④增大CO的浓度⑤增大水蒸气的浓度
| A.①②③ | B.④⑤ | C.①⑤ | D.⑤ |
在密闭容器中进行合成氨的反应,达到平衡后,将体系中各物质的浓度增大到原来的2倍,则产生的结果是()
| A.平衡向正反应方向移动 | B.平衡向逆反应方向移动 |
| C.平衡不移动 | D.NH3的百分含量增加 |