下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物。反应②、④是工业上的重要反应,部分物质及反应条件没有列出。
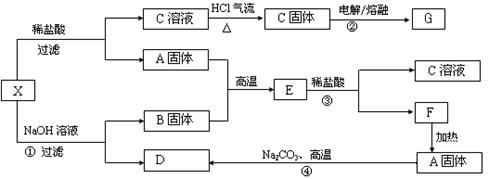 |
请回答:
(1) 写出A、B和E的化学式:A ,B ,E 。
(2) 写出C溶液转化为C固体的过程中,HCl气流的作用 。
(3) 写出①、③和④反应的化学反应方程式(若是离子反应的写离子方程式):
①
③
④
.根据电离理论:在水溶液中电离出的___________全部是__________的化合物,叫做酸。因此酸具有通性,请用离子方程式表示下列酸的通性:
(1)盐酸溶解铁锈(Fe2O3):_________________________________________________
(2)盐酸与小苏打(NaHCO3):______________________________________________
(3)硫酸溶解氢氧化铜:____________________________________________________
(4)实验室用H2SO4和锌反应制取H2:________________________________________
.现有以下物质:
①NaCl晶体②干冰③液态的醋酸④铜⑤BaSO4固体⑥蔗糖⑦酒精
⑧熔融的KNO3 ⑨浓HNO3
回答下列问题(填序号);以上物质能导电的是____________ __________;以上物质属于非电解质的是_______________________;以上物质属于电解质的是_________________;
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式。
(2)已知:N2(g)+ O2(g)=" 2" NO(g)△H = +180 kJ • mol-1
2NO(g)+2 CO(g)= N2(g) + 2 CO2(g)△H =" -" 746 kJ • mol-1
则反应CO(g) + O2(g)= CO2(g)的△H = kJ • mol-1
O2(g)= CO2(g)的△H = kJ • mol-1
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g)△H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为,该反应的平衡常数表达式K =。
2NH3(g)△H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为,该反应的平衡常数表达式K =。
(4) 在固定体积的密闭容器中,1.0×103kPa时反应 N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H<0 的平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
51 |
K1 |
K2 |
①K1K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变
利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,溶液中只存在OH—、H+、NH4+、Cl-四种离子,且c(NH4+)>c(Cl-)>c(OH—)>c(H+),则这两种溶质是 _________。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:。
(3)以石墨电极电解100 mL 0.1 mol·L-1CuSO4溶液。若阳极上产生气体的物质的量为0.01 mol,则阴极上析出Cu的质量为g。
(4)将AgCl分别放入①5mL H2O ②10mL0.2mol·L-1 MgCl2③20 mL0.5mol·L-1 NaCl溶液④40 mL0.1mol·L-1HCl中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是________________。
(5)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如右图所示,B点溶液的pH=7(忽略溶液体积变化),则c(HCl)=_________mol·L-1。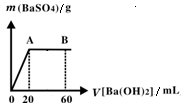
氯碱工业中电解饱和食盐水的原理示意图如下图所示:
(1)电极a是电源的。
(2)溶液A的溶质是(填化学式)。
(3)电解饱和食盐水的离子方程式是。
(4)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 _______________________________________________________。
(5)电解所用的盐水需精制,去除盐水中的Ca2+、Mg2+、NH4+和SO42-,提供的试剂有① Na2CO3溶液② BaCl2 溶液③ NaOH溶液④ HCl,加入试剂的顺序是________________。