某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。
请根据实验步骤,回答下列问题:
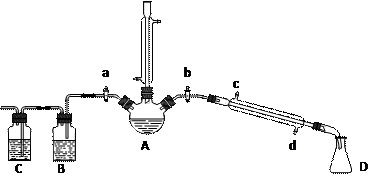 |
⑴关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。冷凝回流的主要目的是 。
⑵理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。
①熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是 。
②有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH2CH2CH3”, 来确定副产物中存在丁醚。请你对该同学的观点进行评价: 。
⑶为了进一步分离、提纯1-溴丁烷,该兴趣小组同学查得相关有机物的有关数据如下:
| 物质 |
熔点/℃ |
沸点/℃ |
| 1-丁醇 |
-89.5 |
117.3 |
| 1-溴丁烷 |
-112.4 |
101.6 |
| 丁醚 |
-95.3 |
142.4 |
| 1-丁烯 |
-185.3 |
-6.5 |
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
② ;③ ;
④ ;⑤ ,收集所得馏分。
⑷若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g 1-溴丁烷,则1-溴丁烷的产率是 。
二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃。用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如下图所示:
(1)装置A中还应安装的玻璃仪器是____,装置B用冰水浴的原因是________.
(2)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:________________.
(3)①实验过程中,装置C中少量的ClO2与NaOH溶液反应产生两种钠盐,且物质的量之比为1:1,其中一种为NaClO2,写出装置C中生成这两种钠盐的离子方程式:_____________________________。
②饱和溶液在温度低于38℃时析出晶体NaClO2.3H2O,在温度高于38℃时析出晶体NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
a.____________________;b________________________;c.洗涤;d.干燥。
(4)还可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备ClO2更受欢迎,其主要原因是______________。
已知HI是一种无色,有刺激性气味,极易溶于水的气体,HI的水溶液称之为氢碘酸,是一种强酸。
(1)请写出碘元素在周期表的位置:第五周期族。
(2)将HI气体通入一定量的浓硫酸中,产生的混合气体除含HI、少量的I2蒸气和水蒸气外,还可能
有气体。
(3)小明拟对HI通入浓硫酸后的混合气体成分进行验证和探究。他设计了如右实验装置图初步探究设计:
①其中直形玻璃管中所装的药品是(写名称)
②足量四氯化碳的两个作用是:,。
进一步探究:
查阅资料:氧化性强弱KMnO4>HNO3>I2>SO42-,且较稀的硝酸不能氧化I2。
③小明拟对溶在水层的其它混合气体成分做进一步探究。请你从以下限选试剂中选择合适的试剂帮小明完成实验报告。
限选的试剂:石蕊试剂、品红溶液、酸性KMnO4溶液、0.1mol/L HNO3、淀粉溶液、BaCl2溶液
| 实验方案 |
可能的现象和相应的结论 |
| 取少量烧杯中的上层溶液分装入A、B两支试管中 |
|
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。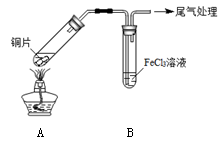
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
| 步骤① |
配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
FeCl3溶液显酸性的原因是_________。写出装置A中产生SO2的化学方程式:_________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:_____________________。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:______________________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
| 步骤② |
往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
| 步骤③ |
往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为_______________。
(4)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III._________________________________。
Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。
已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
II.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是_____________。
(2)吸收塔中的原料B可以选用____________(填字母序号)。
a.NaCl溶液 b.Na2CO3溶液c.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3的过程(加热装置已略去)。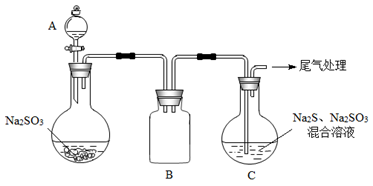
①A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是______。装置B的作用是_______。
②C中制备Na2S2O3发生的连续反应有:Na2S +H2O +SO2===Na2SO3 +H2S、_____和__________。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为_________________。
FeSO4•7H2O广泛用于医药和工业领域。以下是FeSO4•7H2O的实验室制备流程图。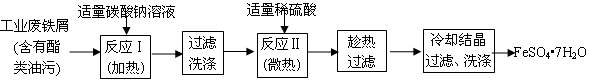
根据题意完成下列填空:
(1)碳酸钠溶液能除去酯类油污,是因为(用离子方程式表示)。
(2)废铁屑中含氧化铁,无需在制备前除去,理由是(用离子方程式回答),。
以下是测定某补血剂(FeSO4•7H2O)中铁元素含量的流程图。根据题意完成下列填空: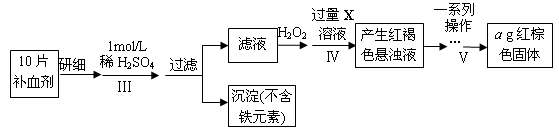
(3)步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及。
(4)步骤Ⅴ一系列操作依次是:①过滤②洗涤③④冷却⑤称量⑥恒重操作。操作⑥的目的是。
(5)假设实验无损耗,则每片补血剂含铁元素的质量g(用含a的代数式表示)。