某校三个研究性学习小组对“葡萄糖溶液与新制的氢氧化铜悬浊液作用得到的砖红色沉淀是Cu2O”提出质疑。
(1)甲小组认为红色沉淀不一定是Cu2O,为此展开了确定红色沉淀成分的研究。
步骤一:提出假设:: 。
步骤二:查阅资料。得出:① +1价的铜在酸性条件下易发生自身氧化还原反应;
② 在空气中灼烧氧化亚铜生成氧化铜。
步骤三:设计方案、实验。
| A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化 |
| B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣 |
| C.取该红色沉淀ag,在空气中充分灼烧至完全变黑,放在干燥器里冷却, 再称重,反复多次至固体恒重,称得质量为bg,比较a,b的关系 |
| D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色 |
沉淀析出。
你认为合理的方案是(填字母) 。
(2)乙小组针对甲小组的假设,另设计如如下图装置进行验证。
若按乙组装置定性检验上述红色沉淀成分,可根据 现象的发生与否即可判断。
若按乙组装置定量测定上述红色沉淀的成分,你认为理论上应该测定下列哪些物理量 (填序号)。
①通入氢气的体积;②反应前红色沉淀和硬质玻管的总质量;③完全反应后红色固体和硬质玻璃管的总质量;④实验前干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后干燥管质量
该实验装置中距实际可行性方面存在的缺陷有
(请写出两点)。
某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装置。
请回答下列问题
(1)写出A中Cu与HNO3反应可能的化学方程式。
(2)实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是;装置中B瓶的作用是。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是。
(4)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是。
(5)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L1;实验后A溶液:V=40mL c(H+)=1.0 mol·L1。假设反应中HNO3既无挥发也无分解,则:参加反应的HNO3的物质的量
为mol。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。请利用A装置中反应后的溶液进行简单的操作,以确定合金中Cu的质量分数,其实验过程为。
在下图所示的装置A中,用KMnO4固体和浓盐酸混合制取Cl2,反应的离子方程式为:2MnO4—+10Cl—+16H+=2Mn2++5Cl2↑+8H2O;装置B中的四处棉花依次做了如下处理:①蘸有淀粉—KI溶液 ②蘸有品红溶液③蘸有紫色石蕊溶液④蘸有浓NaOH溶液。(图中夹持装置已略去)。
回答下列问题:
(1)p中盛装试剂的名称为。
(2)反应开始后,观察到的实验现象是:
①处:;②处:;
③处:。
(3)写出④处反应的离子方式:。
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示“步骤二”中溶液变红的原因:、。
(2)甲同学探究“步骤二”中溶液褪色的原因:
实验I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
实验II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
实验III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
①实验I的说明;
②实验III的目的是。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制①mol•L-1 的FeCl2溶液,重复“步骤二”中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的原因可能是②。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 |
试剂及操作 |
现象 |
| i |
③ |
生成白色沉淀 |
| ii |
向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 |
④ |
硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。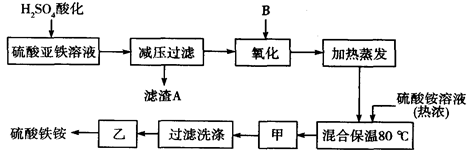
请回答下列问题:
(1)下列物质中最适合的氧化剂B是;
a.NaClOb.H2O2c.KMnO4d.K2Cr2O7
反应的离子方程式。
(2)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,能否用酸性的KMnO4溶液?并说明理由。(可用文字或方程式说明)
(3)检验硫酸铁铵中NH4+的方法是。
(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba (NO3)2的溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________。
某学生为了探究钠与CO2的反应,利用如图装置进行实验.(已知PdCl2能被CO还原得到黑色的Pd)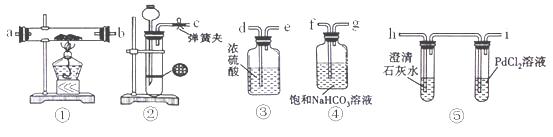
(1)请将上图各装置连接完整(填写装置中字母):c接f,接,接,接。
(2)若用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是。
| A.NaNO3溶液 | B.CCl4 | C.苯 | D.稀硝酸 |
(3)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到时再点燃酒精灯。
(4)反应过程中CO2足量,假如反应过程中有下列两种情况,分别写出两种情况下钠与CO2反应的化学方程式。
Ⅰ.装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体.。
Ⅱ.装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入到足量稀盐酸中产生224mL(标准状况)CO2气体,且溶液中还有固体残留.。