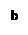实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
(1)反应中浓硫酸的作用是___________________
(2)甲试管中混合溶液的加入顺序:___________________________________;
(3)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
| A.中和乙酸和乙醇。 |
| B.中和乙酸并吸收部分乙醇。 |
| C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。 |
| D.加速酯的生成,提高其产率。 |
(4)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有__________;分离时,乙酸乙酯应该从仪器________ (填:“下口放” 或“上口倒”)出。
(5)生成乙酸乙酯的反应是可逆反应,反应一段时间后,就达到了该反应的限度.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) __________
①混合物中各物质的浓度不再变化;②单位时间里,生成1mol乙醇,同时生成1mol乙酸;③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸.
环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体。实验室常用铬酸氧化环己醇制备,但铬酸较贵且污染环境。某化学兴趣尝试用中学化学更常见的次氯酸钠代替铬酸制备环己酮。有关物质信息、实验流程及实验装置如下:
环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,密度(相对水=1):0.95,熔点:-45℃,沸点:155℃,溶解度(100mL H2O):2.4g(31℃)。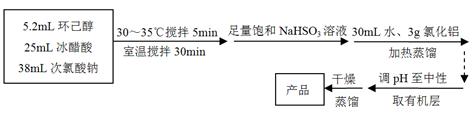

主反应:
回答下列问题:
(1)仪器A的名称是。
(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有、。
(3)加入饱和NaHSO3溶液时发生的主要反应是(用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是。
(4)为将馏出液的pH调至中性,可以加入的试剂是。
| A.稀盐酸 | B.无水碳酸钠 | C.浓硫酸 | D.氢氧化钠固体 |
(5)调节pH后还需加入精制食盐,其目的是,“取有机层”时使用的主要仪器是。(填下图对应的字母)。
(6)实验条件的优化对实验成败至关重要,小组成员觉得有必要对NaClO溶液的最佳浓度进行探究。他们配制了一系列不同浓度的NaClO溶液,并用滴定法标定。具体方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于锥形瓶中,加入适量稀盐酸和KI固体(足量),用0.1000mol/L Na2S2O3标准溶液滴定至终点(用淀粉溶液作指示剂),三次平行实验平均消耗Na2S2O3标准溶液18.00mL,已知I2+2Na2S2O3==2NaI+Na2S4O6 。则该NaClO溶液的浓度是。
用9mol/L的浓硫酸稀释成 0.9mol/L的稀硫酸 100mL ,回答下列问题:
(1)配制操作可分解成如下几步,以下正确的操作顺序是_____________________
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2 cm
(2)如果实验室用98%的浓硫酸(密度为1.8g·cm-3 ) 配制3.6 mol·L-1的稀硫酸250mL。计算用量简量取所需浓硫酸的体积为_____________mL。
(3)由于错误操作, 使得到的浓度数据比正确的偏大的是___________(填写序号)。
A.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
C.容量瓶用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配好的溶液倒入用蒸馏水洗净而未干的试剂瓶中备用
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因:、。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
①实验I的说明;②实验III的目的是。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制①mol•L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是②。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 |
试剂及操作 |
现象 |
| i |
③ |
生成白色沉淀 |
| ii |
向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 |
④ |
(14分)某化学兴趣小组的同学进行草酸亚铁晶体(FeC2O4·nH2O)分解的实验探究。经小组讨论,他们设计了如下装置进行实验。烧瓶B中盛有饱和NH4Cl和饱和NaNO2混合液(常用于实验室制N2),干燥管C1、C4中装有碱石灰,试管E1、E3、E4中装有澄清石灰水。
(1)充分反应后,将D1中的固体残余物投入足量经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为 。
(2)该实验装置中有3个酒精灯,至少应该点次酒精灯,最先点燃的酒精灯是,最后点燃的是。
(3)该实验装置中有4个直立的试管,它们与盛放试剂体现不同的作用,其中E2的作用是: 。
(4)该实验装置中有4个干燥管,C3中盛装的试剂是。
(5)取7.2 g样品充分反应后,测得D1中的固体残余物为2.88 g,D2中固体质量减轻0.64 g,则草酸亚铁晶体(FeC2O4·nH2O)分解的方程式为 。
Ⅰ.实验室经常要制取某种气体并验证该气体的性质。
(1)下列装置不适合用作尾气吸收的是(填序号)。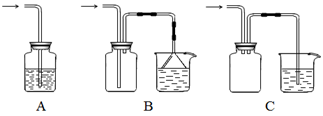
(2)向下列装置中通入气体X,A中品红溶液褪色,则X可能是SO2、Cl2等等。如果要证明X 是SO2气体,接下来的操作是:________________________________
Ⅱ.实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀。有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象。请完成以下空白:
(1)取一定体积的0.1mol.L-1NaOH溶液放于烧杯中,加热煮沸后,再滴入几滴植物油;
(2)选择装置________(填“甲”或“乙”),将(1)所得溶液加入到装置中并按图示组装好装置。在你选择的装置上标明电极材料B为____________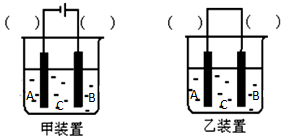
(3)实验中可在某电极处附近看到稳定的白色Fe(OH)2沉淀。若把NaOH溶液换成NaCl溶液,一段时间后则最先在处附近(填A、B或C)看到稳定的白色沉淀。为了尽快看到稳定的白色沉淀,可以采取的措施是(只写一种即可)
(4)如果要看到白色沉淀转化为红褐色沉淀的的现象,接下来的操作可以是__________