下列实验操作或实验设计正确的是
| A.用碱式滴定管准确取出25.00mL 1 mol/L高锰酸钾溶液 |
| B.将溴丙烷与足量氢氧化钠溶液混合加热,冷却后加 硝酸银溶液,检验其中溴元素 |
| C.用氢氧化钠固体与稀盐酸混合,测量混合前后温度变化, 证明中和反应是放热反应 |
| D.用右图装置干燥氨气, |
下列各组离子在常温下一定能大量共存的是( )
| A.pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+ |
| B.在c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、K+、Cl- |
| C.加入铝粉能放出H2的溶液中:Na+、NH4+、CO32-、Cl- |
| D.含有大量Fe3+的溶液中:Al3+、SCN-、Br-、Na+ |
下列离子方程式正确的是( )
| A.Fe(NO3)3溶液中加入过量的HI(强酸)溶液:2Fe3+ + 2I- = 2Fe2+ + I2 |
| B.用惰性电极电解硫酸铜溶液:2Cu2+ + 2H2O 通电 2H2↑+ 2Cu + O2↑ |
| C.碳酸钡与稀硫酸反应:BaCO3 + H2SO4 = BaSO4 + H2O + CO2↑ |
| D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32- + 6H+ + 2MnO4- = 5SO42- + 2Mn2+ + 3H2O |
有机物甲(结构如图所示)是合成西洛他唑(商品名platal)的重要中间体,也是合成抗血栓药、哮喘药、强心药等药的重要中间体。下列对它的分析合理的是()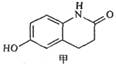
| A.甲分子中可能所有原子共平面 |
| B.甲分子的分子式是C9H6O2N |
| C.甲分子遇FeCl3溶液呈现紫色 |
| D.1mol甲最多可以分别和1 mol NaOH、1 mol Br2反应 |
关于某无色溶液中所含离子的鉴别,下列判断正确的是( )
| A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在 |
| B.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在 |
| C.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在 |
| D.加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 |
在2L恒容密闭容器中,加入X和Y各4mol,一定条件下发生化学反应:
2X(g)+ 2Y(g) Z(g)+2 W(g);△H<0, 反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是( )
Z(g)+2 W(g);△H<0, 反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是( )
| A.5s内平均反应速率为υ(Y)=" 0.2" mol/(L·s) |
| B.达到平衡时Y的转化率为50% |
| C.保持容积体积不变,向容器中通入稀有气体可提高反应物的转化率 |
| D.升高温度,当测得容器中密度不变时,表示该反应已经达到平衡状态 |