明矾石的主要成分为K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质。某校研究小组利用明矾石制备氢氧化铝的流程如下: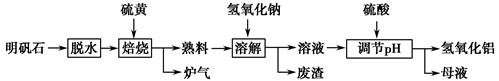
(1)“焙烧”过程中反应的化学方程式为 Al2(SO4)3+
Al2(SO4)3+ S
S
 Al2O3+
Al2O3+ ________↑。
________↑。
(2)分离溶液和废渣的操作是________,“溶解”时反应的离子方程式为_________________________________。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是________。
(4)“母液”中可回收的物质是________。
(5)若“焙烧”过程中恰好消耗48 g硫黄,则理论上最终可得到________ g氢氧化铝。
某课外小组对一些金属单质和化合物的性质进行探究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 |
实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 |
|
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[设其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应______________________________________________________;
化合反应______________________________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是________________________。
解释此现象的离子方程式是______________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿炼锰的原理是(用化学方程式来表示)________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是_____________________________________。
下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题: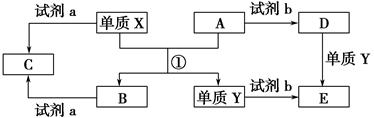
(1)请写出反应①的化学方程式_____________________________________。
(2)检验D溶液中Y离子的方法是__________________________________。
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式______________________________。
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是________________________________________。
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 m3,则阴极产物的质量为________kg。
锌(Zinc)是第四“常见”的金属,仅次于铁、铝及铜,在现代工业中对于电池制造有不可磨灭的贡献。
Ⅰ.湿法炼锌
某种冶炼过程可用下图简略表示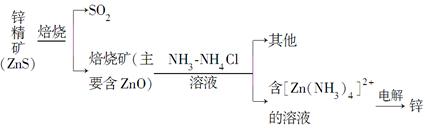
(1)ZnS焙烧反应的化学方程式为___________________________________。
(2)电解过程中析锌一极的电极反应式为_____________________________。
(3)氧化锌像氧化铝一样,属于两性氧化物,则氧化锌与氢氧化钠反应的离子方程式为_______________________________________________________。
(已知:“锌酸”的化学式可写成H2[Zn(OH)4])
Ⅱ.锌电池
用锌作负极的电池生活中随处可见,如锌锰干电池、锌锰碱性电池、锌空电池等。
(4)锌锰碱性电池,以二氧化锰为正极,锌粒为负极,氢氧化钾溶液为电解液。其具有容量大、放电电流大的特点,因而得到广泛应用。电池总反应式为Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2。
碱性电池中,负极锌由片状改变成粒状的优点是__________________________;正极反应式为________________________
(5)新型锌空电池(如图)与锂电池相比,锌空气充电电池的储存电量是它的三倍,成本是锂电池的一半,并且完全没有过热爆炸的安全隐患。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为________________________________________。
若以该电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有10.8 g银析出,至少需要________L空气(折算成标准状况)进入该电池。
(1)[2013·四川理综,11(4)]以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2该电池反应的化学方程式是______________________________。
(2)[2013·重庆理综,11(2)]化学在环境保护中起着十分重要的作用,催化反硝化学法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3—的原理如图所示。
①电源正极为__________(填A或B),阴极反应式为__________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为__________克。
(3)[2013·新课Ⅱ,36(1)]锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造如图所示。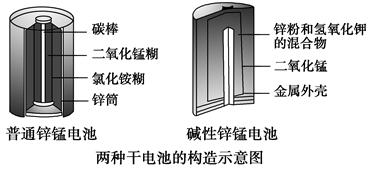
回答下列问题:
普通锌锰电池放电时发生的主要反应为
Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是________,正极发生的主要反应是_____________________________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是________________。