在真空中,用高能电子轰击一种气体分子时,分子中的一个电子可以被轰击出去,生成阳离子自由基。如苯甲酸分子被轰击:
C6H5COOH® C6H5COOH++e
其阳离子的式量与所带电荷数之比( )为122(即
)为122(即 ),与此同时,这样的离子还会被轰击成其它形式的碎片离子(都只带一个单位的正电荷)。各有它们的
),与此同时,这样的离子还会被轰击成其它形式的碎片离子(都只带一个单位的正电荷)。各有它们的 ;由苯甲酸形成的碎片离子按所测得的
;由苯甲酸形成的碎片离子按所测得的 大小排列有:122、105、77、51……。
大小排列有:122、105、77、51……。
 |
碎片离子 |
有关反应 |
| 105 |
C6H5CO+ |
C6H5COOH+® C6H5CO++OH |
| 77 |
C6H5+ |
C6H5CO+® C6H5++CO |
| 51 |
C4H3+ |
C6H5+®C4H3++C2H2 |
| …… |
…… |
…… |
现有中学常用的有机化合物A,仅由C、H、O元素组成,通常A是一种无色透明的液体,不溶于水,加热后能逐渐溶于稀NaOH溶液或稀H2SO4溶液,冷却后不再析出原有的液体。若用高能电子束轰击气体A分子时,在70eV下可得 为88、73、61、45、29、27、15等的离子(均只带一个正电荷)。回答下列问题:
为88、73、61、45、29、27、15等的离子(均只带一个正电荷)。回答下列问题:
(1)有机物A的相对分子质量是 ,分子式是 ;
(2) 为88的离子是 ;
为88的离子是 ;
(3) 为15的离子是 。
为15的离子是 。
工业上利用电解污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
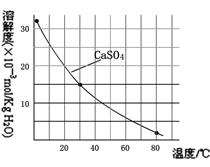
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
| Fe3+ |
Cu2+ |
Cr3+ |
|
| 开始沉淀pH |
2.1 |
4.7 |
4.3 |
| 完全沉淀pH |
3.2 |
6.7 |
a |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH范围为:~;②将浊液加热到80℃,。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是。
氢是一种重要的非金属元素。氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用。
(1)工业上一般采用CO和H2反应合成可再生能源甲醇。反应如下:
CO(g) + 2H2(g)  CH3OH(g) ΔH= -90.1KJ·mol-1
CH3OH(g) ΔH= -90.1KJ·mol-1
在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol·L-1)变化如下表所示:(前6min没有改变条件)
| 2min |
4min |
6min |
8min |
… |
|
| CO |
0.07 |
0.06 |
0.06 |
0.05 |
… |
| H2 |
x |
0.12 |
0.12 |
0.20 |
… |
| CH3OH |
0.03 |
0.04 |
0.04 |
0.05 |
… |
①x=。
②250℃时该反应的平衡常数K的计算式为:(不必化简)。
③若6min~8min只改变了某一条件,所改变的具体条件是。
④第8min时,该反应是不是达到平衡状态。(填“是”或“不是”)
(2)某硝酸厂处理尾气中的NO的方法是用H2将NO还原为N2。已知:
H2还原NO生成氮气和水蒸气的热化学方程式是。
磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)磺酰氯可与白磷发生反应为:P4+ 10SO2Cl2= 4PCl5 + 10SO2↑,若生成1molSO2,则转移电子的物质的量为mol。
(2)某学习小组的同学依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图甲。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图甲。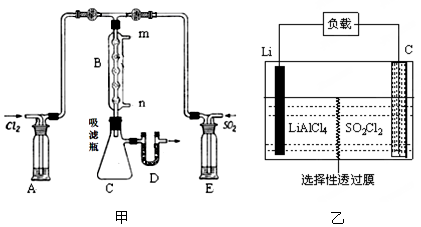
①若用浓盐酸与二氧化锰为原料制取Cl2,其反应的化学方程式为。
②有关题图甲所示的装置说法正确的是(不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和Na2SO3溶液
b.D处U形管中盛放的可以是碱石灰
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶若放在冰水中冷却,更有利于SO2Cl2的收集
③从化学平衡移动角度分析,反应管通水冷却的目的为。
(3)GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li + SO2Cl2 =" 2LiCl" + SO2↑,则电池工作时,正极的电极反应式为。
无机化合物可根据其组成和性质进行分类,以下是一组对“一些物质与水反应”的分类图,请按要求填空。
(1)上述分类中,分成A、B两组的依据是。
(2)C组物质与水反应的离子方程式为。
(3)D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶1的物质有(填化学式)。
(选考)【化学——物质结构与性质】
W、Q、R、X、Y、Z六种元素的原子序数逐渐增大。已知W原子1s轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn。请回答下列问题:
(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是,该分子中含有____个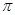 键。
键。
(2)Z原子的核外电子排布式为 ;向Z的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中Z的离子与NH3之间的化学键为。
(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于____晶体;W、Q、X三种元素之间可以形成多种化合物,其中邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,理由是。邻甲基苯甲醛分子中碳原子轨道的杂化类型为。1 mol 苯甲醛分子中σ键为mol。
(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。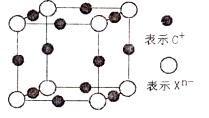
该晶体中阳离子和阴离子个数比为____,晶体中每个Xn-被 个等距离的C+离子包围。