如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因 (用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)__ ___0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填>、<、=)
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c (Na+)-c (A-)= mol·L-1; c (OH-)- c (HA)= mol·L-1
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7 (填>、<、=);
(5)将相同温度下相同浓度的四种盐溶液:A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列 (填序号)
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A==H++HA- HA- H++A2-完成以下问题:
H++A2-完成以下问题:
(1)Na2A溶液显______(填“酸性”“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度_______0.11 mol·L-1(填“>”“=”或“<”)。
(3)锅炉水垢中的CaSO4,可用Na2CO3溶液处理,转化为CaCO3,而后用酸除去。过程中发生:CaSO4(1)+ CO32- CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K=(计算结果保留三位有效数字)
CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K=(计算结果保留三位有效数字)
下表为周期表的一部分,其中的编号代表对应的元素。请回答下列问题: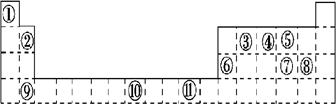
(1)表中属于ds区的元素是_____ (填编号)。
(2)  其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有元素(填元素符号)。
其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有元素(填元素符号)。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子成对电子为_ _对。
(4)比较下列数值的大小(选填“>”“<”“=”)
第一电离能:④⑤;电负性:⑦⑧
已知金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH。
(1)实验室配制FeCl2溶液时需加入少许盐酸和铁粉,若只加盐酸、不加铁粉,溶液中会发生什么变化,用离子方程式表示为:;
(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。
①加氧化剂X的目的是,下列氧化剂中最适合作氧化剂X的是(填序号);
| A.NaClO | B.H2O2 | C.KMnO4 | D.HNO3 |
②物质Y的化学式是;加入物质Y的目的是调节溶液的pH至a,使Fe3+沉淀完全,则a的范围是;若25℃时,a=3的溶液中,c(Fe3+)=mol·L-1。(25℃时,Ksp[Fe(OH)3]=4.0×10-38)
(3)欲将CuCl2·2H2O加热制得无水CuCl2,将采用什么方法和措施?__________。
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
|
| 电离平衡常数 |
Ka=1.8×10-5 |
Kal=4.3×10-7 |
Ka2=5.6×10-11 |
Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是。
A.c(H+)B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=mol·L-1(填精确值)。
(5)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c (OH-)=2c(H2CO3)+;
②c(H+)+c(Na+)=。
A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为,C的元素符号为;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为,其基态原子的电子排布式为。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为,其E+ 的电子排布式为。