现有常温下的0.1mol·L-1纯碱溶液。
(1)你认为该溶液呈碱性的原因是(用离子方程式表示): ①
为证明你的上述观点,请设计一个简单的实验,简述实验过程: ②
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO2-3 离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确。 ③
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是
④
| A.c(Na+)=2c(CO2-3 ) | B.c(CO2-3 )>c(OH-)>c(HCO-3)>c(H2CO3) |
| C.c(CO2-3 )+c(HCO-3)=0.1mol·L-1 | D.c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) |
下图是某药物中间体(只含C、H、O三种元素)的结构示意图: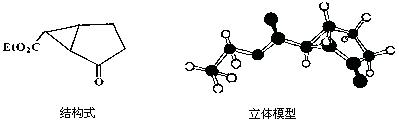
 试回答下列问题:
试回答下列问题:
⑴观察上面的结构式与立体模型,通过对比指出结构式中的“Et”表示;该药物中间体分子的化学式为。
⑵请你根据结构示意图,推测该化合物所能发生的反应类型(除燃烧外)。
⑶解决有机分子结构问题的最强有力手段是核磁共振氢谱(PMR)。有机化合物分子中有几种化学环境不同的氢原子,在PMR中就有几个不同的吸收峰,吸收峰的面积(强度)与H原子数目成正比。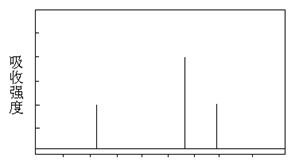
现有一种芳香族化合物与该药物中间体互为同分异构体,其模拟的核磁共振氢谱图如上图所示,试写出该化合物的结构简式:。
(1)现有下列A、B两组物质:
A组:CH3—CHCl—CH3、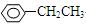 、HCOOH、CH3COOC2H5。
、HCOOH、CH3COOC2H5。
B组:CH3CH2CH2OH、银氨溶液、NaOH溶液、Na2CO3溶液。试回答:
①A组中能跟B组中所有物质都可发生反应。
②B组中可跟A组中三种物质反应。
(2)CH3OH、A、B分子量依次增大14,但彼此不是同系物,请写出符合条件的
A、B的结构简式,A B(写出一组即可)
(4分)已知:CH2=CH-CH=CH2和Br2按物质的量之比1:1发生加成反应时,可得到两种产物:CH2BrCHBrCH=CH2与CH2BrCH=CHCH2Br,
则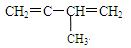
①和Br2 按物质的量之比1:1发生加成反应时,可得到种产物
②和HBr按物质的量之比1:1发生加成反应时,可得到种产物。
如 图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)
图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g) 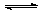 Z(g)+2W(g),达到平衡时V(A)=1.2aL。试回答:
Z(g)+2W(g),达到平衡时V(A)=1.2aL。试回答: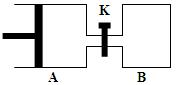
⑴A中X的转化率为。
⑵A、B中X转化率大小关系为AB(填“>”、
“<”、“="”" )
⑶打开K,一段时间后又达到新的平衡时,A的体积为L(连通管中气体体积不计)
某可逆反应进行过程中,在不同反应时间各物质的量的变化情况如图所示。则该反应的化学方程式为;反应开始至2分钟,能否用C表示反应速率吗?(填“能”或不能”),原因。