合成氨是人类科学技术上的一项重大突破,工业上以天然气为原料合成氨。其生产
工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.1 kJ/mol
CO(g)+3H2(g) ΔH=+206.1 kJ/mol
①在一个密闭容器中进行上述反应, 测得CH4的物质的量浓度随反应时间的变化如下图1所示,10min时,改变的外界条件可能是 。
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O。在相同温度下发生反应,并维持反应过程中温度不变。则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)
α乙(CH4)

(2)转化阶段发生的可逆反应为:CO(g)+H2O(g) CO2(g)+H2(g),在一定温度下,反应的平衡常数为K=1。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g),在一定温度下,反应的平衡常数为K=1。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO |
H2O |
CO2 |
H2 |
| 0.5 mol |
8.5 mol |
2.0 mol |
2.0 mol |
此时反应中正、逆反应速率的关系式是 (填序号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g) 2NH3(g) ∆H=-92.4kJ/mol,根据勒夏特列原理,简述提高合成氨原料转化率的一种方法 。
2NH3(g) ∆H=-92.4kJ/mol,根据勒夏特列原理,简述提高合成氨原料转化率的一种方法 。
(4)工业合成氨的热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为_________;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c 均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量__________(填“>”“<”或“=”)92.4 kJ。
③在一定温度下,在一个容积不变的密闭容器中,发生合成氨反应,下列能判断该反应达到化学平衡状态的是____________
a.v(N2)=3v(NH3)
b.混合气体的密度不随时间改变
c.混合气体的平均相对分子质量不随时间改变
d.容器中的压强不随时间改变
e.c(N2)=c(NH3)
(共5分)如图转化关系中A—H为中学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体。已知单质乙、化合物A为黄色(或淡黄色)固体。乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程。B、F两种气体都能使澄清石灰水变浑浊。(部分反应物或产物略去)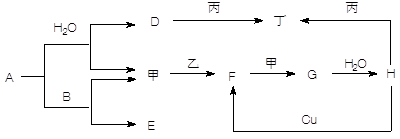
(1)写出下列反应的化学方程式:
A与B ____________________________________________________
Cu与H ___________________________________________________
F与甲____________________________________________________
(2)写出丙与D溶液反应的离子方程式 _______________________________________
(3)常温时H的浓溶液与丙物质并不能看到明显的反应现象,原因是_____________。
(共7分)某同学设计了下图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
(1)若A为浓氨水,B为氧化钙,C中盛有AlCl3溶液,旋开活塞E,足够长时间后,观察到C中的现象为,圆底烧瓶中发生反应的化学方程式为;
(2)若A为30%的H2O2溶液,B为二氧化锰,C中盛有酸化过的FeCl2溶液,旋开活塞E后,C中的现象为,圆底烧瓶中发生反应的化学方程式为;
(3)利用上述装置还可以验证SO2的化学性质, A为较浓硫酸,B为亚硫酸钠,则C中盛有
溶液可验证SO2的氧化性; C中盛有溶液可验证其还原性; 而C中盛有溶液可验证其漂白性。
(共8分)A、B、C、D、E、F六种物质的相互转化关系如下图所示,其中反应①是置换反应。
一.若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行。写出②的离子方程式:_____________________________
二.若A为金属单质,D为非金属单质,且所含元素的原子序数A是D的2倍,原子核外最外层电子数D是A的2倍,③④反应中都有红棕色气体生成,②③④反应中的部分产物已略去。写出①的化学方程式:____写出④的化学方程式:
____ __;在②③④反应中F既表现氧化性又表现酸性的是(填序号)__ ______。
(共6分)A、B、C是中学化学常见的三种有色物质(其组成元素的核电荷数均小于18),其摩尔质量依次减小,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂。请写出A、B、C分别与水反应的离子方程式。
⑴ A与H2O __________________________________。
⑵ B与H2O _________________________________。
⑶ C与H2O __________________________________。
(共14分)
(1)下列操作错误的是_________(填序号)
A. 用蒸发皿进行加热蒸发实验时,不垫石棉网。
B. 浓硫酸不慎沾到皮肤上,迅速用NaOH溶液清洗,再用水洗。
C. 蒸馏时,将温度计水银球插入液面以下。
D. 闻气体气味时,用手在容器口轻轻扇动,使少量气体飘入鼻孔中。
E. 使用分液漏斗和容量瓶时,首先检查是否漏液。
(2) 最近媒体报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84
消毒液”(有效成分是NaClO)发生氯气中毒的事件。根据你所学的氧化还原反应知识,用
离子方程式表示产生氯气的原因:
(3) 已知向偏铝酸钠溶液中加入稀盐酸有氢氧化铝生成。某同学根据所学知识,提出不能使用该方法制取A1(OH)3,理由为。(用离子方程式表示)请你另举出一种用氯化铝溶液制取A1(OH)3的合理方法,该反应的离子方程式为。
(4)据有关报道。目前已能冶炼出纯度高达99.9999%的铁,下列关于纯铁的叙述中,正确的是(填字母)。
A.硬度比钢小,熔点比钢高 B.不能与盐酸反应
C.与不锈钢成分相同 D.在冷的浓硫酸中钝化
(5)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色时停止加热,所得分散系的分散质大小范围是。
(6)合成氨工业生产中常用铁触媒做催化剂,其主要成分是FeO、Fe2O3。已知某铁触媒中,铁、氧离子的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为。