(7分)常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和20.00 mL 0.1000 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示:
(1)由A、C点判断,滴定HCl溶液的曲线是______(填“图1”或“图2”);
(2)a=________ mL; (3)c(Na+)=c(CH3COO-)的点是________
(4)E点对应离子浓度由大到小的顺序为____________________________________。
(5)该温度下CH3COOH的电离常数为_____________________(列式代入数据计算)
(6) 当NaOH溶液滴定CH3COOH溶液过程中,NaOH溶液消耗了10.00 mL时, 则此时混合液中c(CH3COOH)_______ c(CH3COO-)(“>”或“<”或“=”).
(7) t℃时,浓度均为0. 0035mol/L的CH3COONa和NaOH的混合液pH=11,则溶液中c(H+) + c(CH3COO-) +2 c(CH3COOH) =____________(t℃时,Kw =4×10-14 mol2/L2)
从含铜、银、金和铂的块状金属废料中提取铂、金、银的一种工艺如下: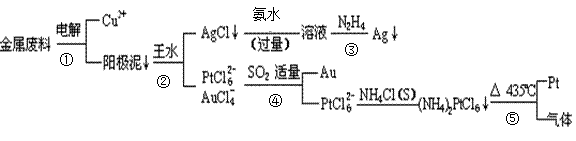
根据以上工艺回答下列问题:
(1)电解时,以_____________为阳极,纯铜为阴极,CuSO4溶液为电解液,则阴极的电极反应方程式为
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:
(3)写出步骤④的离子方程式:
(4)金和浓硝酸反应的化学方程式为:Au +6HNO3(浓)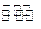 Au(NO3)3+3NO2↑+ 3H2O,因该反应正向进行的程度极小,所以金几乎不溶于浓硝酸,但金却可以溶于王水,试简要解释之:
Au(NO3)3+3NO2↑+ 3H2O,因该反应正向进行的程度极小,所以金几乎不溶于浓硝酸,但金却可以溶于王水,试简要解释之:
(5)写出反应⑤的化学反应方程式
____________________________________________________________________________
短周期元素A、B、C、D在周期表中的位置如下图所示,回答下列问题:
| A |
B |
C |
| D |
(1)设A、B、C、D四种元素的原子序数之和为M,则M____________。
A.必为奇数B.必为偶数C.可能为奇数,也可能为偶数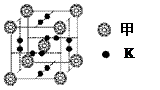 (2)若D是地壳中含量位居第二的元素,其单质是制造太阳能电池板的关键材料,其氧化物在数据传输方面贡献突出,则:
(2)若D是地壳中含量位居第二的元素,其单质是制造太阳能电池板的关键材料,其氧化物在数据传输方面贡献突出,则:
①D的元素符号为____________;
②B形成的一种单质分子(甲)可以和钾“掺杂”
在一起制造出化合物乙,其晶胞如右图所示,则该晶
体中甲分子和钾原子的个数比为 ;
(3)若D元素原子的次外层电子数等于其它各层电子数之和,则:
①用电子式表示D元素氢化物的形成过程 ;
②过量A元素的氢化物与D元素最高价氧化物对应水化物反应生成化合物Z,则 Z的水溶液中所有离子的浓度由大到小的顺序为 ;
Z的水溶液中所有离子的浓度由大到小的顺序为 ;
③用上述某元素的氢化物X与另一元素的氧化物Y反应,可生成一种强酸,则X、Y可能为:
和 ,或 和 (填分子式)。
如图所示,将等物质量的Cl2和CH4充入一容积为25 mL 的量筒,并将量筒倒置在盛有饱和食盐水的水槽中,用日光散射,可观察到的现象是: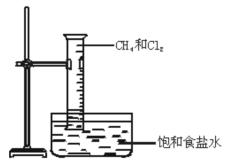
(1);
(2);
(3)。
在烃的分子结构中,每减少2个氢原子,则碳碳间便增加一对共用电子。已知分子组成为CnH2n+2的烃分子中碳碳间的共用电子对数为 n – 1,则化学式为CnH2n-2的烃分子结构中,碳碳间的共用电子对数为,Cx 也可视为烃脱氢后的产物,则C60中碳碳间的共用电子对数为;若某碳单质分子中碳碳间的共用电子对数为 140 ,则该单质的分子式为。
(1)烷烃分子CnH20中,n值应为,相对分子质量为128的烷烃的分子式为,碳、氢的质量比为9:2的烷烃,其结构简式为。
(2)某气态烃在标准状况下的密度是1.34g/L,其相对分子质量为,在该烃中碳的质量分数为80%,则其分子中碳、氢原子的个数比为,化学是为。