(1)Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,其实质促进了水的电离,水的Kw (“增大”或“减小”或“不变”),试写出CO32-水解的离子方程式 。加水稀释后,pH (“增大”或“减小”或“不变”,下同),c(HCO3-)/c(CO32-) 。
(2)25℃时,某HCl溶液中c(H+)=1×10-4 mol/L,则该溶液中c (OH-)= ,
(3)某温度(t℃)时,测得0.01mol·L-1 ,100ml的NaOH溶液的pH=11,
①则该温度下水的Kw= 。
②加水稀释后pH=10, 则应加入 ml的水。(忽略混合后体积的变化,下同)。
③该温度下将pH=2的硫酸和pH=13的氢氧化钠溶液混合后溶液呈中性,则硫酸和氢氧化钠溶液的体积比=_________
已知高温条件下2Al+Fe2O3=2Fe+Al2O3放出大量的热,据说可用于定向爆破和焊接铁轨。请问
①该反应中氧化剂是_____________,______________元素被氧化。
②标出该反应的电子转移方向和数目__________________________________。
③欲除去产物中的Al2O3,请写出所加试剂的离子反应方程式___________________________。
在花瓶中加入固体“鲜花保鲜剂”,能延长鲜花的寿命。下表是1 L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g ·mol-1) |
| 蔗糖 |
57.00 |
342 |
| 硫酸钾 |
1.74 |
174 |
| 阿司匹林 |
0.36 |
180 |
| 高锰酸钾 |
3.16 |
158 |
| 硝酸银 |
0.04 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于电解质的是__________。
A、蔗糖 B、硫酸钾 C、高锰酸钾溶液 D、硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为____________mol·L-1。
(3)配制上述1 L“鲜花保鲜剂”所需的仪器有:______________、烧杯、玻璃棒、
药匙、___________、_____________、。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是_________。
A、将药品放入容量瓶中加蒸馏水溶解
B、容量瓶在使用前未干燥,里面有少量蒸馏水
C、容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D、定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
请按要求写出:(1)过氧化钠与水反应的化学方程式:________________________。
(2)碳酸氢钠受热分解的化学方程式:________________________。
(3)Al与NaOH溶液反应的化学方程式:_________________________。
(4)用小苏打治疗胃酸过多的离子方程式:___________________________。
(5)在反应MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O(反应条件略去)中,氧化剂与还原剂的物质的量之比为________________________________。
已知A、B、C、D都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他3种元素既不在同一周期又不在同一主族。B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D原子的L层电子数与最外层电子数之比为4:1,其d轨道中有一对成对电子。请回答:
(1)A与C形成的共价化合物的分子式是 ,中心原子杂化类型是__ ,分子的立体结构是 ,是 分子(填“极性”或“非极性”)
(2)B与C比较,电负性较小的是 (填元素符号);B与C形成的化合物晶体类型是 。
(3)D位于元素周期表中第 族,D2+的结构示意图是 ,它的+3价离子的电子排布式为 。
(4)A与B形成的化合物分子极易溶于水,其原因是 。
(5)由C原子构成的晶体中微粒间作用力是 ,右图是由C单质构成的晶体的一个晶胞,若设该晶胞的边长为a cm,NA表示阿伏加德罗常数,则该晶体的密度是 g/cm3.(只要求列出算式)。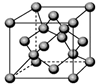
有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 |
Na+、Ba2+、NH |
| 阴离子 |
CH3COO-、OH-、Cl-、SO |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象。
(1)A是______ ____,B是___ ___(填化学式) 。
用离子方程式表示A的水溶液中存在的平衡关系: 。
(2)写出C和D反应的离子方程式__________ _。
(3)25 ℃时,0.1 mol·L-1 B溶液的pH=a,则B溶液中:c(H+)-c(OH—)=_____ ____(填微粒浓度符号)=_____ ______(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 _。
(5)在一定体积的0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是_ _____。
(6)现使用酸碱中和滴定法测定市售白醋的总酸量(g·100mL-1)。在本实验的滴定过程中,下列操作会使实验结果偏大的是__ (填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出