下列关于粒子结构的描述不正确的是( )
| A.H2S和NH3均是价电子总数为8的极性分子 |
| B.HS-和HCl均是含一个极性键的18电子粒子 |
| C.CH2C12和CCl4均是四面体构型的非极性分子 |
| D.1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值) |
某烃分子中有一个环和两个双键,它的分子式可能是
| A.C7H8 | B.C4H6 | C.C5H6 | D.C2H4 |
有一种有机物结构简式为 CH=CH2推测它不可能具有下列哪种性质
CH=CH2推测它不可能具有下列哪种性质
| A.能被酸性高锰酸钾溶液氧化 | B.能与溴水发生加成反应褪色 |
| C.能发生加聚反应 | D.易溶于水,也易溶于有机溶剂 |
下列有机物的系统命名中正确的是
| A.3—甲基—4—乙基戊烷 | B.3,3,4—三甲基己烷 |
| C.3,4,4—三甲基己烷 | D.3,5—二甲基己烷 |
我们经常对大量盆栽 鲜花施用了S诱抗素制剂,以保持鲜花盛开。S诱抗素的分子结构如图,下列关于该分子说法正确的是
鲜花施用了S诱抗素制剂,以保持鲜花盛开。S诱抗素的分子结构如图,下列关于该分子说法正确的是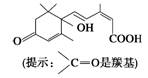
| A.含有碳碳双键、羟基、羰基、羧基 |
| B.含有苯环、羟基、羰基、羧基 |
| C.含有羟基、羰基、羧基、酯基 |
| D.含有碳碳双键、苯环、羟基、羰基 |
下列有机物在H’-NMR(氢的核磁共振谱图)上只给出一组峰的是
| A.HCHO | B.CH3OH | C.HCOOH | D.CH3COOCH3 |