80℃时,2L密闭容器中充入0.40molN2O4,发生反应N2O4 2NO2 △H=+QkJ·mol-1(Q>0) ,获得如下数据:
2NO2 △H=+QkJ·mol-1(Q>0) ,获得如下数据:
| 时间/s |
0 |
20 |
40 |
60 |
80 |
100 |
| c(NO2)/mol·L-1 |
0.00 |
0.12 |
0.20 |
0.26 |
0.30 |
0.30 |
下列判断正确的是
A.升高温度该反应的平衡常数K减小
B.20—40s内,v(N2O4)=0.004mol/(L·s)
C.反应达平衡时,吸收的热量为0.30QkJ
D.100s时再通入0.40molN2O4,达新平衡时N2O4的转化率增大
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应A(s)+2B(g)  C(g)+D(g)已达到平衡状态①各气体物质的物质的量浓度②气体的总物质的量③混合气体的压强④混合气体的密度
C(g)+D(g)已达到平衡状态①各气体物质的物质的量浓度②气体的总物质的量③混合气体的压强④混合气体的密度
| A.只有①② | B.只有①④ | C.只有①③④ | D.①②③④ |
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“ · ”代表一种元素,其中O点代表氢元素.下列说法中错误的是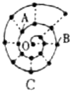
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族
C.B元素是图中金属性最强的元素
D.B、C最高价氧化物的水化物可以相互反应
实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口顺序为a接( )接( )接( )接( )接f(填接口字母)()
| A.b c d e | B.d e b c | C.d e c b | D.e d b c |
在一定温度下,10 mL 0.40mol/LH2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。下列叙述不正确的是(溶液体积变化忽略不计)
| t/min |
0 |
2 |
4 |
6 |
8 |
10 |
| V(O2)/mL |
0.0 |
9.9 |
17.2 |
22.4 |
26.5 |
29.9 |
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C.反应到6 min时,c(H2O2)=0.30mol/L
D.反应到6 min时,H2O2分解了50%
下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第6项应为( )
| 1 |
2 |
3 |
4 |
5 |
…… |
| CH4 |
C2H6 |
C5H12 |
C8H18 |
…… |
…… |
A.C14H30 B.C17H36C.C20H42D.C26H54