著名化学家罗伯特·波义耳(RobertBoyle)在一次实验中,不小心将盐酸溅到紫罗兰花瓣上,过了一会儿,他惊奇地发现,紫色的花瓣上出现了红点。波义耳对这一意外的发现作出了多种假设,经过多次实验验证,探究普遍规律,终于获得了成功。对紫罗兰花瓣遇盐酸变红的现象,你有哪些假设?请将你的各种假设以及验证假设的实验方案填写在下表中。
| 你对紫罗兰花瓣遇盐酸变红现象的各种假设 |
你验证假设的实验方案 |
| |
|
锗及其化合物被广泛应用于半导体、催化剂等领域。以铅锌矿含锗烟尘为原料可制备GeO2,其工艺流程图如下。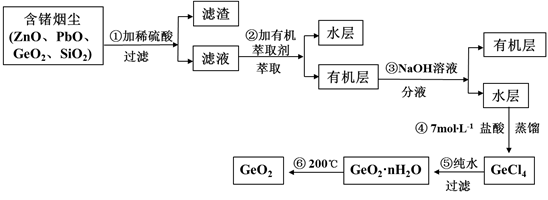
已知:GeO2是两性氧化物;GeCl4易水解,沸点86.6℃
(1)第①步滤渣主要成分有(填化学式),实验室萃取操作用到的玻璃仪器有。
(2)第③步萃取时,锗的萃取率与V水相/V有机相(水相和有机相的体积比)的关系如下图所示,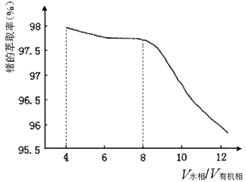
从生产成本角度考虑,较适宜的V水相/V有机相的值为。
(3)第④步加入盐酸作用(答两点即可)。
(4)第⑤步反应的化学方程式。
(5)检验GeO2·nH2O是否洗涤干净的操作是。
(6)GeO2产品中通常混有少量SiO2。取样品5.4g,测得其中氧原子的物质的量为0.105mol,则该样品中GeO2的物质的量为_____ mol。
(15分)日用牙膏的主要成分有:活性物质、摩擦剂、甘油等。假设牙膏中摩擦剂成分为CaCO3、SiO2、Al(OH)3中的一种或几种物质组成,牙膏中其他成分均可溶于益酸,且无气体产生。
(1)牙膏中添加甘油主要作用____。
为进一步探究牙膏中摩擦剂成分,进行了以下探究:
I摩擦剂成分的定性检验:设计实验方案,验证假设。请写出实验步骤以及预期现象和结论(可不填满也可补充)。可选的试剂:稀盐酸,稀硫酸,NaOH溶液,澄清石灰水
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤 |
有难溶物存在 |
| 步骤2: |
①有无色气泡产生,说明有CaCO3; ②_________,说明有______。 |
| 步骤3: |
|
| …… |
II.牙膏样品中碳酸钙的定量测定
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(2)实验过程中需持续缓缓通入空气。其主要作用。
(3)仪器C中选择Ba(OH)2而不选择Ca(OH)2溶液原因:①。②。
(4)下列各项措施中,能提高测定准确度的是____(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.缓慢滴加稀盐酸
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取10.00g样品三份,进行三次测定,洌得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为____。若改测定C中生成BaCO3质量为测定装置C在吸收CO2前后的质量差来确定CaCO3的质量分数,两方法测定的结果____(填“相同”或“不同”),原因是。
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下: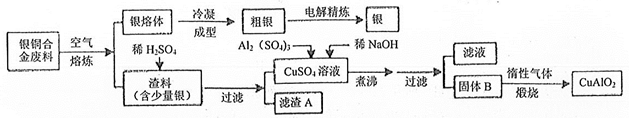
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,电解质溶液可选用;滤渣A与稀HNO3反应的化学方程式为。
(2)固体混合物B的组成为;过滤得到固体B时,实验室如何进行洗涤操作?。
(3)在第一步过滤所得的CuSO4溶液中含有过量的硫酸,若要用该溶液来检测糖尿病需要对溶液进行哪些处理。检测糖尿病时发生的反应方程。
(4)完成煅烧过程中一个反应的化学方程式:CuO+ Al2O2 CuAlO2+↑。
CuAlO2+↑。
(5)理论上生产6.15kgCuAlO2需要含铜的质量分数为64%的银铜合金废料kg。
(8分)有人设计了如图所示实验,以确认某混合气体中含有C2H4和SO2。
混合气体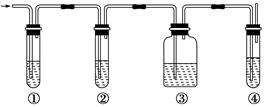
所需试剂有
| A.品红溶液 | B.NaOH溶液 | C.浓H2SO4 | D.酸性高锰酸钾溶液 |
试回答下列问题:
(1)写出图中①、②、③、④装置可盛放的试剂(将上述有关试剂的序号填入空格内):
①________,②________,③________,④________。
(2)使用装置②的目的是_____________________________________________________。
(3)确定乙烯存在的现象是____________________________________________________
(15分)某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.验证同周期主族元素金属性和非金属性的变化规律
(1)将钠、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
与盐酸反应最剧烈,与盐酸反应产生的气体最多。Al与HCl反应的离子方程式为_____
(2)向Na2S溶液中通入氯气出现现象,可证明Cl的非金属性比 S强,反应的离子方程式为。
Ⅱ.利用如图装置验证同主族元素非金属性的变化规律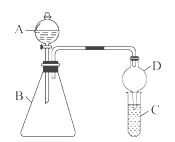
(3)仪器B的名称为,干燥管D的作用为防止。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液的现象即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有溶液的洗气瓶除去。