(15分)日用牙膏的主要成分有:活性物质、摩擦剂、甘油等。假设牙膏中摩擦剂成分为CaCO3、SiO2、Al(OH)3中的一种或几种物质组成,牙膏中其他成分均可溶于益酸,且无气体产生。
(1)牙膏中添加甘油主要作用____。
为进一步探究牙膏中摩擦剂成分,进行了以下探究:
I摩擦剂成分的定性检验:设计实验方案,验证假设。请写出实验步骤以及预期现象和结论(可不填满也可补充)。可选的试剂:稀盐酸,稀硫酸,NaOH溶液,澄清石灰水
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤 |
有难溶物存在 |
| 步骤2: |
①有无色气泡产生,说明有CaCO3; ②_________,说明有______。 |
| 步骤3: |
|
| …… |
|
II.牙膏样品中碳酸钙的定量测定
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(2)实验过程中需持续缓缓通入空气。其主要作用 。
(3)仪器C中选择Ba(OH)2而不选择Ca(OH)2溶液原因:① 。② 。
(4)下列各项措施中,能提高测定准确度的是____(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.缓慢滴加稀盐酸
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取10.00g样品三份,进行三次测定,洌得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为____。若改测定C中生成BaCO3质量为测定装置C在吸收CO2前后的质量差来确定CaCO3的质量分数,两方法测定的结果____(填“相同”或“不同”),原因是 。
某实验小组利用下图所示实验装置,使氢气平缓地通过装有金属钙的硬质玻璃管制取氢化钙,并分析产品的成分及纯度。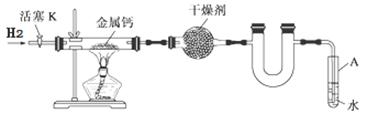
(1)试管A的作用有;。
(2)请将下列制备氢化钙的操作步骤补充完整:
①打开活塞K通入H2;
②;
③点燃酒精灯,进行反应;
④反应结束后,;
⑤拆除装置,取出产物。
(3)经分析,产品中只含钙、氢两种元素。取少量产品,小心加入水中,观察到有气泡冒出,滴入一滴酚酞试液,溶液变红。反应的化学方程式可能有CaH2+2H2O=Ca(OH)2+2H2↑、。
(4)取2.30 g产品溶于蒸馏水,配成500 mL溶液;取25.00 mL该溶液于锥形瓶中,滴入2滴酚酞试液,用0.2500 mol/L 盐酸滴定;三次平行实验,平均消耗盐酸22.00 mL。
①配制溶液所用的玻璃仪器有胶头滴管、烧杯、玻璃棒、量筒、;
②判断滴定终点的方法是;
③产品中两种成分物质的量之比为。
(共14分)乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下: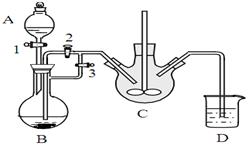
回答下列问题:
(1)NH4HCO3盛放在装置中(填字母),该装置中涉及的主要反应的离子方程式_
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是_
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。铁粉的作用是。反应结束后,无需过滤,除去过量铁粉的方法是_
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是。
经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70mL。滴定反应如下:
Ce4++Fe2+=Ce3++Fe3+
则产品中乳酸亚铁的质量分数为_
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图装置制取氨气,你所选择的试剂是。
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是:、。
液体石蜡鼓泡瓶的作用是:。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是____ (填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40 ℃以下烘干
③尾气处理装置如图所示。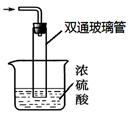
双通玻璃管的作用:;浓硫酸的作用:、。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。
则样品中氨基甲酸铵的物质的量分数为 _____。
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
(1)碱浸前将铬铁矿粉碎的作用。
(2)反应器①中除发生题中所给反应外,请写出其他两个化学方程式(要求两个反应中反应物均不相同);。③中调节PH=7-8所得滤渣为、。
(3)从平衡角度分析④中酸化的原理;
(4)用简要的文字说明操作⑤加入KCl能得到K2Cr2O7晶体的原因是。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25.00mL于碘量瓶中,向其中加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32—=2I—+S4O62—)
①判断达到滴定终点的依据是;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应)(保留2位有效数字)。
下图是实验室制取、提纯氯气及研究氯气性质的装置图。请回答: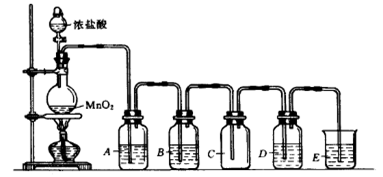
(1)上图实验室制备氯气的化学反应方程式为。
(2)通常用向上排空气法或者排饱和食盐水法收集氯气,若要利用C瓶收集到干燥纯净的氯气,B瓶所装的试剂是。(填名称)
(3)若D瓶中装有硝酸银溶液,则观察到的现象是。
(4)E装置用来,写出E装置中发生化学反应的离子方程式。