某化学兴趣小组进行有关电解食盐水的探究实验,电解装置如图所示。
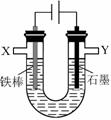
实验一:电解饱和食盐水。
(1)配制饱和食盐水所需的玻璃仪器有:烧杯、量筒、 。
(2)电解饱和食盐水的化学方程式为 。
实验二:电解不饱和食盐水及产物分析。
相同条件下,电解1mol·L-1 NaCl溶液并收集两极产生的气体。在X处收集到V1mL气体,同时,在Y处收集到V2mL气体,停止电解。结果发现V2<V1,且与电解饱和食盐水相比,Y处收集到的气体颜色明显较浅。经讨论分析,导致上述现象的原因有:
ⅰ.有部分Cl2溶于NaCl溶液中;ⅱ.有O2生成。
(3)设计实验证明有部分Cl2溶于NaCl溶液中。实验方案为:取少量 电极附近溶液。
(4)证明有O2生成并测定O2的体积。按如右图所示装置进行实验,通过注射器缓缓地将在Y处收集到V2mL气体全部推入装置A(盛有足量试剂NaOH溶液)中,最终,量气管中收集到V3mL气体(设V1、V2、V3均在相同条件下测得)。

①装置A的作用是 。
②本实验中,观察到________________的现象,说明石墨电极上有O2生成。
③实验中是否需要预先除尽装置中的空气? (填“是”或“否”)。
(5)实验二中,在石墨电极上产生的Cl2的总体积为 mL(用代数式表示)。
实验室用 98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的 H2SO4溶液950mL.
(1)需要使用的主要仪器有量筒、烧杯、玻棒、、。
(2)其操作步骤可分解为以下几步:
A.用量筒量取mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):
( D)→( A )→( C )→()→()→()→( F )。
③容量瓶在使用前必须进行的操作是。
④将浓硫酸在烧杯中稀释后移入容量瓶时,必须_____________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视刻度线,会导致所配溶液浓度会;(填: 偏高、偏低、或无影响,下同)
②定容时,眼睛俯视刻度线,所配溶液浓度会;
③定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度,所配溶液浓度会.
④容量瓶未干燥即用配制溶液.
⑤往容量瓶转移时,有少量液体溅出.
I.如下图所示,50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在装置中进行中
和反应。通过测定反应过程中所放出的热量,可计算中和热,回答下列问题:
(1)图中装置缺少的仪器是 。
(2)下列说法不正确的是(填序号)。
A.若用50mL0.55mol·L-1Ba(OH)2溶液代替NaOH溶液进行实验,测得的中和热相同
B.若用50mL0.50mol·L-1醋酸溶液代替盐酸进行实验,测得的中和热相同
C.若分别用等浓度的硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行实验,测得的中和热相同
D.NaOH溶液稍过量的原因是让盐酸完全反应
II.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B.用标准溶液润洗滴定管2-3次
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)实验中眼睛注视_______________,直至滴定终点。判断到达终点的现象是__________________。
(3)若三次实验所用KOH溶液体积分别为14.98 mL,16.80 mL,15.02 mL则c(HCl)=。
(4)下列操作中,可能造成测定结果偏高的是。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管中液面刻度,其它操作均正确
C.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线: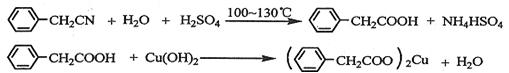
制备苯乙酸的装置示意图如下(加热和夹持装置等略):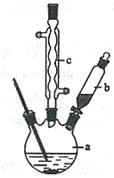
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是;仪器c的名称是,其作用是。反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是。下列仪器中可用于分离苯乙酸粗品的是(填标号)。
| A.分液漏斗 | B.漏斗 | C.烧杯 | D.直形冷凝管E.玻璃棒 |
(3)提纯粗苯乙酸的方法是,最终得到44 g纯品,则苯乙酸的产率是。
(4)用CuCl2• 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是。
下图是实验室用来验证乙烯与氢气反应产物的装置,请回答下列问题:
(1)此装置用来制取乙烯,其中包括的仪器是:
①碎瓷片②石棉网和铁架台③圆底烧瓶④温度计(量程 100℃)⑤温度计(量程200℃)⑥酒精灯⑦单孔塞 ⑧双孔塞⑨导管。不选用的仪器有___________ (填其序号)
(2)写出实验室制取乙烯的化学方程式 。
(3)此处碱石灰的作用是。
(4)实验过程中,发现溴水会褪色,可能的原因是。
(5)装置中点燃的气体刚开始为,出现什么现象可说明生成了乙烷?
选用如下实验装置组合后完成用浓盐酸、二氧化锰共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉的实验。已知①工业制漂白粉反应为放热反应。②温度稍高即发生副反应6Cl2+6Ca(OH)2==5CaCl2+Ca(ClO3)2+6H2O。
⑴选用各装置的接口顺序为(填图中小写英文字母)。
⑵制漂白粉的装置选择(填C或D)装置的原因
。
F装置的作用是
写出F中发生反应的化学方程式
⑶实验中若用12mol﹒L-1的浓盐酸100mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是小于0.15mol,其可能的主要原因是
(假定各步反应均无反应物损耗且无副反应发生)。