某溶液A,可能含有等物质的量浓度的SiO32-、CO32-、SO32-、S2-、AlO2-、Cl-、PO43-中的几种,现进行以下实验:
(1)以10mLA溶液,往其中通入足量的CO2,得到白色沉淀B,B可完全溶于稀硫酸。
(2)另取10mLA溶液,往其中加入稀硫酸,生成气体C,将C通入Pb(NO3)2溶液中,有黑色沉淀D生成。
问题:
(1)溶液A中肯定存在:_____________________________________.
(2)溶液A中肯定不存在:______________________________,其理由是:___________________.
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是;
(2)称取碳素钢6.0 g放入足量浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用;
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水d.酸性KMnO4溶液
②乙同学取0.56 L(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有M和N两种气体,其中M是密度最小的气体。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
(3)装置B中试剂的作用是;
(4)写出Y气体中的N气体生成的化学方程式:
(5)为确认N的存在,需在装置中添加洗气瓶M于;
a.A之前b.A~B间c.B~C间d.C~D间
(6)如果气体Y中含有M,预计实验现象应是。
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: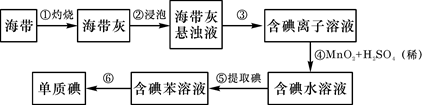
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器的字母代号填写在空白处)。
| A.烧杯 |
| B.坩埚 |
| C.表面皿 |
| D.泥三角 |
E.酒精灯
(2)步骤③的实验操作名称是:;
(3)步骤④反应的离子方程式是:;
(4)一种检验提取碘后的水溶液中是否还含有单质碘的简单方法是:。
某化学兴趣小组测定某过氧化氢溶液中过氧化氢的浓度,进行如下实验:
取20.00 mL的该过氧化氢溶液加水稀释至250.00 mL,取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。据此作答:
(1)滴定时,将高锰酸钾标准溶液注入________(填“酸式”或“碱式”)滴定管中;滴定到达终点的现象是:________________。
(2)配置标准溶液时使用的KMnO4固体中如果含有少量K2SO4杂质,则对测定结果的影响是________。(填“偏大”、“偏小”或“不变”)
(3)重复滴定四次,分别耗用c mol/L KMnO4标准溶液的体积为:0.99V mL、1.03V mL、1.28V mL、0.98V mL,则原过氧化氢溶液中的物质的量浓度为____________mol·L-1。
实验室制备1,2—二溴乙烷的反应原理如下:CH3CH2OH  CH2=CH2,CH2=CH2+Br2
CH2=CH2,CH2=CH2+Br2 BrCH2CH2Br。用少量的溴和足量的乙醇制备l,2—二溴乙烷的装置如下图所示:
BrCH2CH2Br。用少量的溴和足量的乙醇制备l,2—二溴乙烷的装置如下图所示:
有关数据列表如下:
| 乙醇 |
1,2—二溴乙烷 |
乙醚 |
|
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g·cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
-130 |
9 |
-116 |
回答下列问题:
(1)在装置c中应加入(选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是。
(3)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的(填“上”或“下”)层。
(4)若产物中有少量未反应的Br2,最好用(填正确选项前的序号)洗涤除去。
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),其主要目的是;但不用冰水进行过度冷却,原因是:。
(6)以1,2—二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2—二溴乙烷通过( ① )反应制得( ② ),②通过( ③ )反应制得氯乙烯,由氯乙烯制得聚氯乙烯。
①______________(填反应类型)
②________________(填该物质的电子式)
③______________(填反应类型)
写出第一步的化学方程式_________________。
甲、乙两同学拟用实验确定某酸HA是弱电解质。他们设计的方案(理论方案)分别是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=3的两种酸溶液各100 mL;
②分别取这两种溶液各1 mL,加水稀释为100 mL;
③用两支试管分别取相同体积的两种稀释液,同时加入纯度相同、颗粒大小均等的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是。
(2)甲方案中,能说明HA是弱电质的理由是测得溶液的pH___1(选填“>”、“<”、“=”)。
(3)关于pH试纸的使用方法,下列叙述正确的是。
a.pH试纸在使用之前应用蒸馏水润湿
b.将pH试纸直接插入待测溶液,取出后再与标准比色卡对比
c.pH试纸测出的数值应该保留一位小数
d.能使pH试纸显红色的溶液显酸性
(4)乙方案中,说明HA是弱电解质的现象是。