1molCH4与Cl2发生取代反应,待反应完成后测得4种取代物物质的量相等,则消耗Cl2为( )
| A.0.5mol | B.2mol | C.2.5mol | D.4mol |
已知盐酸与硫酸跟烧碱的稀溶液反应的热化学方程式为:H+(aq)+OH-(aq) H2O(l) ΔH=Q1 kJ·mol-1,又知:H2SO4(aq)+2KOH(aq)
H2O(l) ΔH=Q1 kJ·mol-1,又知:H2SO4(aq)+2KOH(aq) K2SO4(aq)+2H2O(l) ΔH=Q2 kJ·mol-1。则Q1和Q2的关系是( )
K2SO4(aq)+2H2O(l) ΔH=Q2 kJ·mol-1。则Q1和Q2的关系是( )
| A.Q1=Q2 | B.2Q1=Q2 | C.Q1<Q2 | D.无法判断 |
将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50)。下列叙述正确的是( )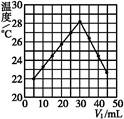
| A.做该实验时环境温度为22 ℃ |
| B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约为1.00 mol·L-1 |
| D.该实验表明有水生成的反应都是放热反应 |
用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液反应,实验中测得起始温度为20.1 ℃,终止温度为23.4 ℃,反应后溶液的比热容为4.18 J·g-1·℃-1,盐酸和NaOH溶液的密度都近似认为是1 g·cm-3,则中和反应生成1 mol 水时放热( )
| A.55.2 kJ | B.391 kJ | C.336 kJ | D.1.38 kJ |
已知1 mol NaOH与HCl完全反应放出57.4 kJ的热量。下列热化学方程式书写正确的是( )
A.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=+28.7 kJ·mol-1 NaCl(aq)+H2O(l) ΔH=+28.7 kJ·mol-1 |
B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=-28.7 kJ·mol-1 NaCl(aq)+H2O(l) ΔH=-28.7 kJ·mol-1 |
C.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=+57.4 kJ·mol-1 NaCl(aq)+H2O(l) ΔH=+57.4 kJ·mol-1 |
D.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1 NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1 |
已知强酸与强碱的稀溶液发生中和反应的热化学方程式为:H+(aq)+OH-(aq) H2O(l) ΔH=-57.3 kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。其焓变ΔH1、ΔH2、ΔH3的关系是( )
H2O(l) ΔH=-57.3 kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。其焓变ΔH1、ΔH2、ΔH3的关系是( )
| A.ΔH1>ΔH2>ΔH3 | B.ΔH1<ΔH3<ΔH2 | C.ΔH1=ΔH3>ΔH2 | D.ΔH1>ΔH3>ΔH2 |