A是一种酯,分子式是C14H12O2,A可以由醇 B跟羧酸C发生酯化反应得到。A不能使溴(CCl4)褪色。氧化B可得C。
(1)写出A、B、C的结构简式:
A____,B____,C____。
(2)写出B的两种同分异构体的结构简式,它们都可以和NaOH溶液反应。____和____。</PGN0022B.TXT/PGN>
硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示: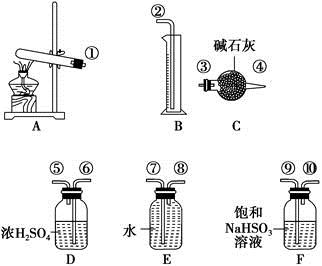
[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有两种;
Ⅲ.所得气体的成分可能含有三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→→→→→②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
| 实验小组 |
称取CuSO4的质量/g |
装置C增加的质量/g |
量筒中水的体积折算成标准状况下气体的体积/mL |
| 一 |
6.4 |
2.56 |
448 |
| 二 |
6.4 |
2.56 |
224 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式。
第一小组:;
第二小组:。
某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
实验:将燃烧的钠迅速伸入到盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。
提出假设
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
设计实验方案验证假设
该小组对燃烧后的白色产物
进行如下探究:
| 实验方案 |
实验操作 |
实验现象 |
结论 |
| 方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质为Na2O |
| 方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
|
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
【思考与交流】
(1)甲同学认为方案1得到的结论不正确,其理由是。
(2)乙同学认为方案2得到的结论正确,白色物质为。
(3)通过方案1和方案2的实验,你认为上述三个假设中,成立。你的理由是。
(4)钠在二氧化碳中燃烧的化学方程式为。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点?并简述理由:。
某研究小组为探究SO2和Fe(NO3)3溶液的反应的实验。设计了如下图所示装置进行实验.已知:1.0 mol/L的Fe(NO3)3溶液的pH=1
请回答:
(1)装置A中用于添加浓硫酸的仪器名称为。
(2)实验前鼓入N2的目的是。
(3)装置B中产生了白色沉淀,其成分是_______,说明SO2具有____性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是。
②按观点2,装置B中反应的离子方程式是。
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号)。
| A.1 mol/L稀硝酸 |
| B.1.5 mol/L Fe(NO3)2溶液 |
| C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
| D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
(1)写出装置A中发生反应的离子方程式:。
(2)写出试剂Y的名称_____________________。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设:
假设一:存在两种成分:NaHCO3和__________
假设二:存在三种成分:NaHCO3和__________、__________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 |
|
| 步骤2:向A试管中滴加_________: |
①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠。 |
| 步骤3:向B试管中滴加________: |
若溶液变浑浊,结合步骤2中的①,则假设一成立:结合步骤2中的②,则假设二成立。 |
(4)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为。
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH﹣)-c(H+)=____(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有___________。
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。
(1)m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是①常温下碳与浓硫酸不反应;②。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式。
(3)B中的现象是;C的作用是。
(4)随着反应的进行,A中还可能发生某些离子反应,写出相应的离子方程式
反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是;
(5)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为(写含m、b的表达式)。
(6)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是(填写代号)。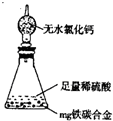
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、称量残渣的质量
C.测定反应前后装置和药品的总质量